La formule du sel avec lequel l'acide chlorhydrique réagit. Acide chlorhydrique et ses sels
- (HCl), une solution aqueuse de chlorure d'hydrogène, un gaz incolore à odeur piquante. Obtenu par l'action de l'acide sulfurique sur le sel commun, comme sous-produit de la chloration des hydrocarbures, ou par la réaction de l'hydrogène et du chlore. L'acide chlorhydrique est utilisé pour ... ... Dictionnaire encyclopédique scientifique et technique
Acide hydrochlorique- - HCl (SC) (acide chlorhydrique, acide chlorhydrique, chlorure d'hydrogène) est une solution de chlorure d'hydrogène (HCl) dans l'eau, un additif antigel. C'est un liquide incolore avec une odeur piquante, sans particules en suspension. ... ... Encyclopédie des termes, définitions et explications matériaux de construction
- (acide chlorhydrique) solution de chlorure d'hydrogène dans l'eau ; acide fort. Un liquide incolore fumant dans l'air (l'acide chlorhydrique technique est jaunâtre en raison des impuretés de Fe, Cl2, etc.). Concentration maximale (à 20 .C) 38% en masse, ... ... Grand dictionnaire encyclopédique
ACIDE HYDROCHLORIQUE- (Acidum muriaticum, Acid, hydrochloricum), une solution de chlorure d'hydrogène (HC1) dans l'eau. Dans la nature, il est présent dans l'eau de certaines sources d'origine volcanique et se retrouve également dans le suc gastrique (jusqu'à 0,5%). Le chlorure d'hydrogène peut être obtenu ... Grande encyclopédie médicale
ACIDE HYDROCHLORIQUE- (acide chlorhydrique, acide chlorhydrique) un acide volatil monobasique fort à odeur piquante, une solution aqueuse de chlorure d'hydrogène ; la concentration maximale est de 38 % en masse, la masse volumique d'une telle solution est de 1,19 g/cm3. Utilisé dans... ... Encyclopédie russe de la protection du travail
ACIDE HYDROCHLORIQUE- (acide chlorhydrique) HCl solution aqueuse de chlorure d'hydrogène, acide monobasique fort, volatil, à odeur piquante ; les impuretés de fer, le chlore le tachent de jaunâtre. Le concentré S. à vendre contient 37% ... ... Grande Encyclopédie Polytechnique
Existe., Nombre de synonymes : 1 acide (171) Dictionnaire des synonymes ASIS. V.N. Trichine. 2013 ... Dictionnaire des synonymes
Encyclopédie moderne
Acide hydrochlorique- ACIDE HYDROGÉNIQUE, solution aqueuse de chlorure d'hydrogène HCl ; un liquide fumant avec une odeur piquante. L'acide chlorhydrique est utilisé pour obtenir divers chlorures, décaper les métaux, traiter les minerais, dans la production de chlore, de soude, de caoutchouc, etc. ... ... Dictionnaire encyclopédique illustré
- (acide chlorhydrique), une solution de chlorure d'hydrogène dans l'eau ; acide fort. Un liquide incolore "fumant" dans l'air (l'acide chlorhydrique technique est jaunâtre en raison des impuretés de Fe, Cl2, etc.). Concentration maximale (à 20°C) 38% en masse,… … Dictionnaire encyclopédique
L'acide chlorhydrique (acide chlorhydrique) - une solution aqueuse de chlorure d'hydrogène HCl, est un liquide clair et incolore avec une odeur piquante de chlorure d'hydrogène. L'acide technique a une couleur vert jaunâtre due aux impuretés de chlore et de sels de fer. La concentration maximale d'acide chlorhydrique est d'environ 36 % de HCl ; une telle solution a une densité de 1,18 g/cm3. L'acide concentré "fume" dans l'air, car le HCl gazeux qui s'échappe forme de minuscules gouttelettes d'acide chlorhydrique avec la vapeur d'eau.
L'acide chlorhydrique n'est pas inflammable, pas explosif. C'est l'un des acides les plus forts, dissout (avec dégagement d'hydrogène et formation de sels - chlorures) tous les métaux dans la série de tensions jusqu'à l'hydrogène. Des chlorures se forment également lors de l'interaction de l'acide chlorhydrique avec des oxydes et hydroxydes métalliques. Avec les oxydants forts, il se comporte comme un réducteur.
Les sels d'acide chlorhydrique - chlorures, à l'exception de AgCl, Hg2Cl2, sont très solubles dans l'eau. Le verre, la céramique, la porcelaine, le graphite, le fluoroplaste lui résistent.
L'acide chlorhydrique est obtenu par dissolution de chlorure d'hydrogène dans l'eau, qui est synthétisé soit directement à partir d'hydrogène et de chlore, soit obtenu par action de l'acide sulfurique sur le chlorure de sodium.
L'acide chlorhydrique technique produit a une concentration d'au moins 31% de HCl (synthétique) et 27,5% de HCl (à partir de NaCl). L'acide commercial est dit concentré s'il contient 24% ou plus de HCl, si la teneur en HCl est inférieure, alors l'acide est dit dilué.
L'acide chlorhydrique est utilisé pour obtenir des chlorures de divers métaux, des intermédiaires organiques et des colorants synthétiques, l'acide acétique, charbon actif, adhésifs divers, alcool hydrolytique, en électroformage. Il est utilisé pour la gravure des métaux, pour le nettoyage de divers récipients, le tubage des tuyaux de forage à partir de carbonates, d'oxydes et d'autres sédiments et contaminants. En métallurgie, les minerais sont traités à l'acide, dans l'industrie du cuir - cuir avant tannage et teinture. L'acide chlorhydrique est utilisé dans le textile, Industrie alimentaire, en médecine, etc.
L'acide chlorhydrique joue un rôle important dans le processus de digestion, il est partie intégrante suc gastrique. L'acide chlorhydrique dilué est prescrit par voie orale principalement pour les maladies associées à une acidité insuffisante du suc gastrique.
L'acide chlorhydrique est transporté dans des bouteilles en verre ou des récipients métalliques gommés (recouverts d'une couche de caoutchouc), ainsi que dans des conteneurs en plastique.
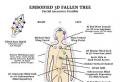
Acide hydrochlorique très dangereux pour la santé humaine. Provoque de graves brûlures au contact de la peau. Le contact visuel est particulièrement dangereux.
Si de l'acide chlorhydrique entre en contact avec la peau, il doit être lavé immédiatement avec un jet d'eau abondant.
Le brouillard et les vapeurs de chlorure d'hydrogène formés lorsque l'acide concentré interagit avec l'air sont très dangereux. Ils irritent les muqueuses et les voies respiratoires. Un travail prolongé dans une atmosphère d'HCI provoque un catarrhe des voies respiratoires, des caries dentaires, une opacification de la cornée des yeux, une ulcération de la muqueuse nasale et des troubles gastro-intestinaux.
L'intoxication aiguë s'accompagne d'enrouement, d'étouffement, d'écoulement nasal, de toux.
En cas de fuite ou de déversement, l'acide chlorhydrique peut provoquer des dégâts environnement . Tout d'abord, cela conduit à la libération de vapeurs de la substance dans air atmosphérique en quantités dépassant les normes sanitaires et hygiéniques, ce qui peut entraîner l'empoisonnement de tous les êtres vivants, ainsi que l'apparition de précipitations acides, ce qui peut entraîner une modification propriétés chimiques le sol et l'eau.
Deuxièmement, il peut s'infiltrer dans eau souterraine entraînant une pollution des eaux intérieures.
Là où l'eau des rivières et des lacs est devenue assez acide (pH inférieur à 5), les poissons disparaissent. En cas d'infraction chaînes trophiques le nombre d'espèces d'animaux aquatiques, d'algues et de bactéries est réduit.
Dans les villes, les précipitations acides accélèrent la destruction des structures, des monuments et des sculptures en marbre et en béton. L'acide chlorhydrique corrode les métaux lorsqu'il entre en contact avec des métaux et réagit avec des substances telles que l'eau de Javel, le dioxyde de manganèse ou le permanganate de potassium pour former du chlore gazeux toxique.
En cas de déversement, l'acide chlorhydrique est lavé des surfaces avec beaucoup d'eau ou une solution alcaline qui neutralise l'acide.
Le matériel a été préparé sur la base d'informations provenant de sources ouvertes
ACIDE HYDROCHLORIQUE (acide hydrochlorique) - un acide monobasique fort, une solution de chlorure d'hydrogène HCl dans l'eau, est l'un des composants les plus importants du suc gastrique; en médecine, il est utilisé comme médicament pour l'insuffisance de la fonction sécrétoire de l'estomac. S. to. est l'un des produits chimiques les plus couramment utilisés. réactifs utilisés dans les laboratoires de diagnostic biochimique, sanitaire-hygiénique et clinique. En dentisterie, une solution à 10% de S. est utilisée pour blanchir les dents atteintes de fluorose (voir Blanchiment des dents). S. to. sert à obtenir de l'alcool, du glucose, du sucre, des colorants organiques, des chlorures, de la gélatine et de la colle, à la ferme. l'industrie, dans le tannage et la teinture du cuir, la saponification des graisses, dans la production de charbon actif, la teinture des tissus, la gravure et le brasage des métaux, dans les procédés hydrométallurgiques pour nettoyer les trous de forage des dépôts de carbonates, d'oxydes et d'autres sédiments, dans la galvanoplastie, etc.
S. à. pour les personnes en contact avec lui au cours du processus de production, il représente un risque professionnel important.
S. to. était connu dès le 15ème siècle. Sa découverte lui est attribuée. Alchimiste Valentin. Pendant longtemps on croyait que S. to. était un composé oxygéné d'un produit chimique hypothétique. élément muria (d'où l'un de ses noms - acidum muriaticum). Chim. La structure de S. to. n'a finalement été établie que dans la première moitié du XIXe siècle. Davy (N. Davy) et J. Gay-Lussac.
Dans la nature, S. libre n'existe pratiquement pas, cependant, ses sels chlorure de sodium (voir Sel de table), chlorure de potassium (voir), chlorure de magnésium (voir), chlorure de calcium (voir), etc. sont très répandus.
Le chlorure d'hydrogène HCl dans des conditions normales est un gaz incolore avec une odeur piquante spécifique; lorsqu'il est libéré dans l'air humide, il "fume" fortement, formant les plus petites gouttelettes d'aérosol S. à Le chlorure d'hydrogène est toxique. Poids (masse) de 1 litre de gaz à 0° et 760 mm Hg. Art. égal à 1,6391 g, densité de l'air 1,268. Le chlorure d'hydrogène liquide bout à -84,8° (760 mmHg) et se solidifie à -114,2°. Dans l'eau, le chlorure d'hydrogène se dissout bien avec dégagement de chaleur et formation de S. à.; sa solubilité dans l'eau (g/100 g H2O) : 82,3 (0°), 72,1 (20°), 67,3 (30°), 63,3 (40°), 59,6 (50° ), 56,1 (60°).
La page to. représente un liquide transparent incolore avec une forte odeur de chlorure d'hydrogène; les impuretés de fer, de chlore ou d'autres substances colorent S. to. d'une couleur jaunâtre-verdâtre.
La valeur approximative de la concentration de S. en pourcentage peut être trouvée si bat. le poids de S. à réduire de un et à multiplier le nombre obtenu par 200 ; par exemple, si poids S. à 1,1341, alors sa concentration est de 26,8 %, soit (1,1341 - 1) 200.
S. à chimiquement très actif. Il dissout avec la libération d'hydrogène tous les métaux qui ont un potentiel normal négatif (voir Potentiels physico-chimiques), convertit de nombreux oxydes et hydroxydes métalliques en chlorures et libère des acides libres à partir de sels tels que les phosphates, les silicates, les borates, etc.
Dans un mélange avec de l'acide nitrique (3:1), le soi-disant. aqua regia, S. to. réagit avec l'or, le platine et d'autres métaux chimiquement inertes, formant des ions complexes (AuC14, PtCl6, etc.). Sous l'influence des oxydants, S. to. est oxydé en chlore (voir).
S. to. réagit avec de nombreuses substances organiques, par exemple des protéines, des glucides, etc. Certaines amines aromatiques, des alcaloïdes naturels et synthétiques et d'autres composés organiques de base forment des sels avec S. to. Le papier, le coton, le lin et de nombreuses fibres artificielles sont détruits par S. to.
La principale méthode de production de chlorure d'hydrogène est la synthèse à partir de chlore et d'hydrogène. La synthèse du chlorure d'hydrogène se déroule selon la réaction H2 + 2C1-^2HCl + 44,126 kcal. D'autres moyens de produire du chlorure d'hydrogène sont la chloration composés organiques, déshydrochloration des dérivés chlorés organiques et hydrolyse de certains composés inorganiques avec élimination du chlorure d'hydrogène. Moins souvent, en laboratoire. pratiquer, appliquer à l'ancienne obtenir du chlorure d'hydrogène par l'interaction du sel de table avec l'acide sulfurique.
Une réaction caractéristique de S. to. et de ses sels est la formation d'un précipité de fromage blanc de chlorure d'argent AgCl, soluble en excès Solution aqueuse ammoniac:
HCl + AgN03 - AgCl + HN03 ; AgCl + 2NH4OH - [Ag (NHs)2] Cl + + 2H20.
Stocker S. à. dans verrerie avec bouchons au sol dans une pièce fraîche.
En 1897, IP Pavlov a découvert que les cellules pariétales des glandes gastriques des humains et d'autres mammifères sécrètent S. à une concentration constante. On suppose que le mécanisme de la sécrétion de S. consiste en le transfert d'ions H+ par un transporteur spécifique à la surface externe de la membrane apicale des tubules intracellulaires des cellules pariétales et en leur entrée après conversion supplémentaire en suc gastrique (voir). Les ions C1~ du sang pénètrent dans la cellule pariétale tout en transférant simultanément l'ion bicarbonate HCO2 en sens inverse. De ce fait, les ions C1 ~ pénètrent dans la cellule pariétale contre le gradient de concentration et de celle-ci dans le suc gastrique. Les cellules pariétales sécrètent une solution
Page to., concentration to-rogo fait env. 160 mmol!l.
Bibliographie: Volfkovich S. I., Egorov A. P. et Epshtein D. A. Technologie chimique générale, volume 1, p. 491 et autres, M.-L., 1952 ; Substances dangereuses dans l'industrie, éd. N.V. Lazarev et I.D. Gadaskina, volume 3, p. 41, L., 1977; Nekrasov B.V. Fundamentals of General Chemistry, volumes 1 - 2, M., 1973 ; Soins d'urgence en cas d'intoxication aiguë, Manuel de toxicologie, éd. S. N. Golikova, p. 197, Moscou, 1977 ; Fondamentaux de la médecine légale, éd. N. V. Popova, p. 380, M.-L., 1938 ; Radbil O. S. Bases pharmacologiques pour le traitement des maladies du système digestif, p. 232, M., 1976; Rem et G. Cours de chimie inorganique, trad. de l'allemand, volume 1, p. 844, M., 1963; Lignes directrices pour l'examen médico-légal des empoisonnements, éd. R. V. Berezhnoy et autres, p. 63, M., 1980.
N. G. Budkovskaïa ; N. V. Korobov (ferme.), A. F. Rubtsov (court.).
Acide hydrochlorique - Substance chimique, qui est représenté par l'interaction de l'eau et du chlorure d'hydrogène. À forme pure l'acide est incolore. vue technique l'acide a une teinte jaunâtre, car il contient du fer, du chlore et quelques autres éléments. L'acide chlorhydrique est utilisé dans de nombreux domaines de la vie humaine. Les domaines d'application de l'acide chlorhydrique sont très divers. Considérons-les plus avant.
L'utilisation de l'acide chlorhydrique dans l'industrie
Par exemple, l'industrie alimentaire utilise l'acide comme additif alimentaire E507. Cet additif est utilisé dans le processus de fabrication des produits à base de vodka, ainsi que de divers sirops. L'utilisation de l'acide chlorhydrique dans l'industrie agro-alimentaire joue principalement le rôle de régulateur de l'état acide des produits. En métallurgie, l'acide chlorhydrique technique est populaire. Il est utilisé pour nettoyer le métal avant le soudage ou l'étamage. La gravure et le décapage dans l'électroformage ne sont pas complets sans la participation de l'acide chlorhydrique. Il crée un environnement actif pour les processus mentionnés ci-dessus.
Afin que l'utilisation de l'acide chlorhydrique dans l'industrie ne crée pas problèmes inutiles, vous devez aborder le choix de son type et de sa concentration avec responsabilité.
L'utilisation de l'acide chlorhydrique dans la vie quotidienne
Vous n'avez probablement pas réfléchi à la composition des produits d'entretien que vous utilisez quotidiennement. Beaucoup d'entre eux contiennent de l'acide chlorhydrique. Utilisation au quotidien, pour la toilette : nous utilisons des produits très acides, c'est pourquoi il ne faut les utiliser qu'avec des gants en caoutchouc. Cela évitera à vos mains de s'irriter.
Les femmes au foyer utilisent une solution d'acide chlorhydrique à la maison. L'utiliser comme détachant aide à éliminer la rouille ou l'encre sur les vêtements. L'acide chlorhydrique doit être conservé dans des récipients en verre hors de portée des jeunes enfants. Si de l'acide chlorhydrique a pénétré sur la peau ou les muqueuses, il est nécessaire de laver immédiatement la zone touchée à l'eau courante. L'utilisation d'acide chlorhydrique à domicile doit être effectuée dans le respect des règles de sécurité. En plus de la capacité d'éliminer les taches difficiles des vêtements, l'acide chlorhydrique est utilisé pour lutter contre le tartre. Afin de ne pas aggraver la situation lors du nettoyage de la vaisselle sale, il est recommandé d'utiliser une certaine concentration d'acide. Dans ces cas, on utilise de l'acide chlorhydrique inhibé, dont l'utilisation permet de maintenir l'intégrité des plats en matériaux fragiles.
Pour garder votre maison et vos vêtements propres, vous devez avoir de l'acide chlorhydrique à la maison. L'utilisation dans la vie quotidienne doit être extrêmement prudente afin de ne pas vous blesser ni nuire aux objets avec lesquels vous interagissez.
L'utilisation de l'acide chlorhydrique en médecine
L'acide chlorhydrique est l'un des composants du suc gastrique humain. Par conséquent, en cas de diminution de sa concentration, un rendez-vous est prescrit médicamentsà base d'acide chlorhydrique. L'utilisation de l'acide chlorhydrique en médecine joue un rôle particulier dans la santé d'une personne atteinte de maladies du tube digestif. En raison de la présence d'une certaine quantité d'acide chlorhydrique dans le suc gastrique, les aliments sont digérés et les micro-organismes qui pénètrent dans l'estomac meurent.
L'acide chlorhydrique est également utilisé pour traiter des maladies de peau spécifiques (verrues). Candidature en la médecine traditionnelle s'est généralisé : pour améliorer la digestion avec une faible acidité du suc gastrique, il est nécessaire de prendre des préparations d'acide chlorhydrique avant les repas. L'utilisation d'acide chlorhydrique (sels) aide à lutter contre les troubles digestifs.
L'utilisation de l'acide chlorhydrique dans la construction
L'acide chlorhydrique est utilisé pour améliorer la qualité de nombreux processus de construction. Par exemple, l'ajout d'acide chlorhydrique à un mélange de béton augmente sa résistance au gel. De plus, le mélange durcit plus rapidement et la maçonnerie devient plus résistante à l'humidité. On connaît également l'utilisation de l'acide chlorhydrique dans la construction comme nettoyant calcaire. La brique rouge est nettoyée de la saleté et des traces de matériaux de construction avec une solution d'acide chlorhydrique à 10%. Il est important de se rappeler que tous les types de briques ne sont pas affectés par l'acide chlorhydrique sans endommager la structure du produit de construction. Par conséquent, vous devez utiliser uniquement de l'acide chlorhydrique à dix pour cent. Une solution chimique d'acide chlorhydrique permet d'économiser considérablement les finances, car d'autres nettoyants peuvent coûter dix fois plus cher.
Le faible coût ne rend pas l'utilisation de l'acide chlorhydrique moins efficace. L'acide est utilisé dans de nombreuses industries : du médical à la construction. Mais, comme tous les autres acides, l'acide chlorhydrique a la capacité d'irriter la peau et des concentrations élevées peuvent entraîner des brûlures.
Vous pouvez acheter de l'acide chlorhydrique en ligne en cliquant sur le lien
L'acide chlorhydrique est une solution de chlorure d'hydrogène dans l'eau. Le chlorure d'hydrogène (HCl) dans des conditions normales est un gaz incolore avec une odeur piquante spécifique. Cependant, nous traitons de ses solutions aqueuses, nous nous concentrerons donc uniquement sur elles.
Acide chlorhydrique - incolore solution claire avec une odeur âcre de chlorure d'hydrogène. En présence d'impuretés de fer, de chlore ou d'autres substances, l'acide a une couleur vert jaunâtre. La densité d'une solution d'acide chlorhydrique dépend de la concentration de chlorure d'hydrogène qu'elle contient; certaines données sont données dans tableau 6.9.
Tableau 6.9. Densité de solutions d'acide chlorhydrique de diverses concentrations à 20°C.
A partir de ce tableau, on peut voir que la dépendance de la densité d'une solution d'acide chlorhydrique à sa concentration avec une précision satisfaisante pour les calculs techniques peut être décrite par la formule:
d = 1 + 0,5*(%) / 100
Lorsque les solutions diluées bouillent, la teneur en HCl dans les vapeurs est inférieure à celle en solution, et lorsque les solutions concentrées bouillent, elle est plus élevée qu'en solution, ce qui se reflète dans la figure. riz. 6.12 diagramme d'équilibre. Un mélange en ébullition constante (azéotrope) à pression atmosphérique a une composition de 20,22 % en poids. HCl, point d'ébullition 108,6°C.
Enfin, un de plus avantage important l'acide chlorhydrique est presque totalement indépendant du moment de son acquisition par rapport à la période de l'année. Vu de riz. N° 6.13, l'acide de concentration industrielle (32-36%) gèle à des températures pratiquement inaccessibles pour la partie européenne de la Russie (de -35 à -45 ° C), contrairement à l'acide sulfurique qui gèle à des températures positives, ce qui nécessite l'introduction de une opération de chauffage du réservoir.
L'acide chlorhydrique n'a pas les inconvénients de l'acide sulfurique.
Premièrement, le chlorure ferrique a une solubilité accrue dans une solution d'acide chlorhydrique. (Fig. 6.14), ce qui permet d'élever la concentration de chlorure ferrique dans la solution à une valeur de 140 g/l et même plus ; le risque de formation de sédiments en surface disparaît.
Le travail avec de l'acide chlorhydrique peut être effectué à n'importe quelle température à l'intérieur du bâtiment (même à 10°C), et cela ne provoque pas de changements notables dans la composition de la solution.

Riz. 6.12. Diagramme d'équilibre liquide - vapeur pour le système HCl - H 2 O.

Riz. 6.13. Schéma de l'état (fusibilité) du système HCl–H 2 O.

Riz. 6.14. Équilibre dans le système HCl - FeCl 2 .
Enfin, un autre avantage très important de l'acide chlorhydrique est compatibilité totale avec un flux qui utilise des chlorures.
Un inconvénient de l'acide chlorhydrique en tant que réactif est sa grande volatilité. Les normes autorisent la concentration de 5 mg/m 3 de volume d'air dans l'atelier. La dépendance de la pression de vapeur à l'état d'équilibre sur l'acide de diverses concentrations en pourcentage est donnée dans tableau 6.10. En général, lorsque la concentration en acide dans le bain est inférieure à 15 % en poids, cette condition est satisfaite. Cependant, lorsque les températures augmentent dans l'atelier (c'est-à-dire heure d'été) il est possible de dépasser cet indicateur. Certaines informations sur la concentration d'acide acceptable à une température d'atelier particulière peuvent être déterminées à partir de riz. 6.15.
La dépendance de la vitesse de gravure sur la concentration et la température est affichée dans riz. 6.16.
Les défauts de décapage sont généralement causés par les éléments suivants :
- utiliser un acide plus ou moins concentré par rapport à l'optimal ;
- courte durée de gravure (la durée de gravure attendue à différentes concentrations d'acide et de fer peut être estimée à partir de riz. 6.17;
- température inférieure par rapport à l'optimum ;
- manque de mélange;
- mouvement laminaire de la solution de décapage.
Ces problèmes sont généralement résolus à l'aide de méthodes technologiques spécifiques.
Tableau 6.10. Dépendance de la concentration d'équilibre de chlorure d'hydrogène sur la concentration d'acide dans le bain.
|
Concentration d'acide, % |
Concentration d'acide, % |
La concentration de HCl dans l'air, mg / m 3 |
|
|
4500 (20°C) |