Алканы как представители предельных углеводородов. Алканы: химические свойства
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Простейшим представителем класса является метан (CH 4).
По номенклатуре ИЮПАК названия алкано в образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи.
Для алканов характерен тип гибридизации - sp 3 .
Пространственное строение - у метана тетраэдрическая форма молекулы, у алканов n>4 - зигзагообразная форма.
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии - изомерией углеродного скелета. Гомологическая разница - -CH 2 -.
Физические свойства
Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи. При нормальных условиях неразветвлённые алканы с CH 4 до C 4 H 10 - газы; с C 5 H 12 до C 13 H 28 - жидкости; после C 14 H 30 - твёрдые тела. Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Химические свойства алканов
1. Реакции замещения.
Галогенирование - это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно - за один этап замещается не более одного атома водорода:
CH 4 + Cl 2 → CH 3 Cl + HCl (хлорметан)
CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорметан)
CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (трихлорметан)
CHCl 3 + Cl 2 → CCl 4 + HCl (тетрахлорметан).
Нитрование алканов (реакция Коновалова)
На алканы действует pазбавленная азотная кислота пpи нагpевании и давлении. В pезультате пpоисходит замещение атома водоpода на остаток азотной кислоты – нитpогpуппу NO 2 .
R- H + HO -NO 2 → R-NO 2 + H 2 O
Эту pеакцию называют pеакцией нитpования, а пpодукты pеакции – нитpосоединениями.
2. Горение.
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH 4 + 2O 2 → CO 2 + 2H 2 O + Q
Значение Q достигает 46 000 - 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
С n Н 2n+2 + (1,5n+0,5)O 2 → nCO 2 + (n+1)H 2 O
3. Крекинг алканов.
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
CH 4 → C + 2H 2 (t > 1000 °C)
C 2 H 6 → 2C + 3H 2
Крекинг – процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью.
Термический крекинг. При температуре 450–700 o С алканы распадаются за счет разрыва связей С–С (более прочные связи С-Н при такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов.
Например:
C 6 H 14 → C 2 H 6 + C 4 H 8
Каталитический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре450°С и атмосферном давлении. При этом наряду с разрывом молекул происходят реакции изомеризации и дегидрирования:
2CH 4 1500 ° C → H–C≡C–H (ацетилен) + 3H 2
4. Изомеризация.
Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации - перестройке углеродного скелета с образованием алканов разветвленного строения.
CH 3 –CH 2 –CH 2 –CH 2 –CH 3 (пентан) –t°,AlCl 3 → CH 3 –CH 2 –CH 2 –CH 3 I
CH 3 (2-метилбутан)
5. Дегидрирование алканов
При нагревании алканов в присутствии катализаторов происходит их каталитическое дегидрирование за счет разрыва связей С-Н и отщепления атомов водорода от соседних углеродных атомов. При этом алкан превращается в алкен с тем же числом углеродных атомов в молекуле:
C n H 2n+2 → C n H 2n + H 2
CH 3 -CH 3 → CH 2 =CH 2 + H 2 (этан → этен)
CH 3 -CH 2 -CH 2 -CH 3 → CH 2 = CH-CH 2 -CH 3 + H 2 (бутан → бутен-1 )
Наряду с бутеном-1 в этой реакции образуется также бутен-2.
6. Реакции окисления алканов
Алканы - соединения с низкими степенями окисления углерода, и в зависимости от условий реакции они могут окисляться с образованием различных соединений.
Получение алканов
Алканы выделяют из природных источников (природный и попутный газы, нефть, каменныйуголь). Используются также синтетические методы.
1. Крекинг нефти (промышленный способ)
При крекинге алканы получаются вместе с непредельными соединениями (алкенами). Этот способ важен тем, что при разрыве молекул высших алканов получается очень ценное сырье для органического синтеза: пропан, бутан, изобутан, изопентан идр.
2. Гидpиpование непpедельных углеводоpодов:
C n H 2n + H2 →C n H 2n+2 ← -H2 C n H 2n-2
алкены → алканы ← алкины
3. Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni):
С + 2Н 2 → СН 4
4. Из синтез-газа (СО + Н 2) получают смесь алканов:
nСО + (2n+1)Н 2 → C n H 2n+ 2 + nH 2 O
5. Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода:
2CH 3 Cl + 2Na → CH 3 -CH 3 + 2NaCl (реакция Вюрца)
6. Из солей карбоновых кислот:
а) сплавление со щелочью (реакция Дюма
CH 3 COONa + NaOH → CH 4 + Na 2 CO 3
ацетат натрия
б) электролиз по Кольбе
2RCOONa + 2H 2 O → R-R + 2CO 2 + H 2 + 2NaOH
на аноде → на катоде
7. Разложение карбидов металлов (метанидов) водой:
Al 4 C 3 + 12HOH → 4Al(OH) 3 + 3CH 4
Применение алканов.
Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива.
Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей.
Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) - пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике.
Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине.
Паpафин (смесь твеpдых алканов С 19 - С 35) - белая твеpдая масса без запаха и вкуса (t пл = 50-70°C) - пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине и т.д.
Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти.
Большое значение имеют галогенопроизводные алканов, которые используются как растворители, хладоагенты и сырье для дальнейших синтезов.
В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
Ациклические углеводороды называются алканами. Всего насчитывается 390 алканов. Самую длинную структуру имеет нонаконтатриктан (C 390 H 782). К атомам углерода могут присоединяться галогены, образуя галогеналканы.
Строение и номенклатура
По определению алканы - предельные или насыщенные углеводороды, имеющие линейную или разветвлённую структуру. Также называются парафинами. Молекулы алканов содержат только одинарные ковалентные связи между атомами углерода. Общая формула -
Чтобы назвать вещество, необходимо соблюсти правила. По международной номенклатуре названия формируются с помощью суффикса -ан. Названия первых четырёх алканов сложились исторически. Начиная с пятого представителя, названия составляются из приставки, обозначающей количество атомов углерода, и суффикса -ан. Например, окта (восемь) образует октан.
Для разветвлённых цепей названия складываются:
- из цифр, указывающих номера атомов углерода, около которых стоят радикалы;
- из названия радикалов;
- из названия главной цепи.
Пример: 4-метилпропан - у четвёртого атома углерода в цепи пропана находится радикал (метил).

Рис. 1. Структурные формулы с названиями алканов.
Каждый десятый алкан даёт называние следующим девяти алканам. После декана идут ундекан, додекан и далее, после эйкозана - генэйкозан, докозан, трикозан и т.д.
Гомологический ряд
Первый представитель - метан, поэтому алканы также называют гомологическим рядом метана. В таблице алканов указаны первые 20 представителей.
|
Название |
Формула |
Название |
Формула |
|
Тридекан |
|||
|
Тетрадекан |
|||
|
Пентадекан |
|||
|
Гексадекан |
|||
|
Гептадекан |
|||
|
Октадекан |
|||
|
Нанадекан |
|||
Начиная с бутана, все алканы имеют структурные изомеры. К названию прибавляется приставка изо-: изобутан, изопентан, изогексан.

Рис. 2. Примеры изомеров.
Физические свойства
Агрегатное состояние веществ меняется в списке гомологов сверху вниз. Чем больше содержится атомов углерода и, соответственно, чем больше молекулярная масса соединений, тем выше температура кипения и твёрже вещество.
Остальные вещества, содержащие больше 15 атомов углерода, находятся в твёрдом состоянии.

Газообразные алканы горят голубым или бесцветным пламенем.
Получение
Алканы, как и другие классы углеводородов, получают из нефти, газа, каменного угля. Для этого используют лабораторные и промышленные методы:
- газификация твёрдого топлива:
C + 2H 2 → CH 4 ;
- гидрирование оксида углерода (II):
CO + 3H 2 → CH 4 + H 2 O;
- гидролиз карбида алюминия:
Al 4 C 3 + 12H 2 O → 4Al(OH) 3 + 3CH 4 ;
- реакция карбида алюминия с сильными кислотами:
Al 4 C 3 + H 2 Cl → CH 4 + AlCl 3 ;
- восстановление галогеналканов (реакция замещения):
2CH 3 Cl + 2Na → CH 3 -CH 3 + 2NaCl;
- гидрирование галогеналканов:
CH 3 Cl + H 2 → CH 4 + HCl;
- сплавление солей уксусной кислоты со щелочами (реакция Дюма):
CH 3 COONa + NaOH → Na 2 CO 3 + CH 4 .
Алканы можно получить гидрированием алкенов и алкинов в присутствии катализатора - платины, никеля, палладия.
Химические свойства
Алканы вступают в реакции с неорганическими веществами:
- горение:
CH 4 + 2O 2 → CO 2 + 2H 2 O;
- галогенирование:
CH 4 + Cl 2 → CH 3 Cl + HCl;
- нитрирование (реакция Коновалова):
CH 4 + HNO 3 → CH 3 NO 2 + H 2 O;
- присоединение:
Алканами в химии называют предельные углеводороды, у которых углеродная цепь является незамкнутой и состоит из углерода, связанных друг с другом при помощи одинарных связей. Также характерной особенностью алканов есть то, что они совсем не содержат двойных либо тройных связей. Порой алканы называют парафинами, дело в том, что парафины собственно и являются смесью предельных углеродов, то есть алканов.
Формула алканов
Формулу алкана можно записать как:
При этом n больше или равно 1.
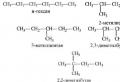
Алканам свойственна изомерия углеродного скелета. При этом соединения могут принимать разные геометрические формы, как например это показано на картинке ниже.

Изомерия углеродного скелета алканов
С увеличением роста углеродной цепи увеличивается и количество изомеров. Так, например, у бутана есть два изомера.

Получение алканов
Алкан как правило получают различными синтетическими методами. Скажем, один из способов получения алкана предполагает реакцию «гидрирования», когда алканы добываются из ненасыщенных углеводов под воздействием катализатора и при температуре.
Физические свойства алканов
Алканы от других веществ отличаются полным отсутствием цвета, также они не растворим в воде. Температура плавления алканов повышается с увеличением их молекулярной массы и длины углеводородной цепи. То есть чем более разветвленным является алкан, тем у него большая температура горения и плавления. Газообразные алканы и вовсе горят бледно-голубым или бесцветным пламенем, при этом выделяя много тепла.
Химические свойства алканов
Алканы в химическом плане малоактивные вещества, по причине прочности крепких сигма связей С-С и С-Н. При этом связи С-С неполярны, а С-Н малополярны. А так как все это малополяризируемые виды связей, которые относятся к сигма виду, то разрываться они будут по механизму гомолитическому, в результате чего образуются радикалы. И как следствия химические свойства алканов представляют собой в основном реакции радикального замещения.
Так выглядит формула радикального замещения алканов (галогенирование алканов).
Помимо этого также можно выделить такие химические реакции как нитрирование алканов (реакция Коновалова).
Реакция эта протекает при температуре 140 С, причем лучше всего именно с третичным атомом углерода.
Крекинг алканов – эта реакция протекает при действии высоких температур и катализаторов. Тогда создаются условия, когда высшие алканы могут рвать свои связи образуя алканы более низкого порядка.
ОПРЕДЕЛЕНИЕ
Алканами называются насыщенные углеводороды, молекулы которых состоят из атомов углерода и водорода, связанных между собой только σ-связями.
В обычных условиях (при 25 o С и атмосферном давлении) первые четыре члена гомологического ряда алканов (C 1 — C 4) - газы. Нормальные алканы от пентана до гептадекана (С 5 - С 17) - жидкости, начиная с С 18 и выше - твердые вещества. По мере увеличения относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы. Строение молекулы алканов на примере метана приведено на рис. 1.
Рис. 1. Строение молекулы метана.
Алканы практически не растворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан, диэтиловый эфир и др.
Получение алканов
Основные источники различных предельных углеводородов, содержащих до 40 атомов углерода, — нефть и природный газ. Алканы с небольшим числом атомов углерода (1 - 10) можно выделить фракционной перегонкой природного газа или бензиновой фракции нефти.
Различают промышленные (I) и лабораторные (II) способы получения алканов.
C + H 2 → CH 4 (kat = Ni, t 0);
CO + 3H 2 → CH 4 + H 2 O (kat = Ni, t 0 = 200 - 300);
CO 2 + 4H 2 → CH 4 + 2H 2 O (kat, t 0).
— гидрирование непредельных углеводородов
CH 3 -CH=CH 2 + H 2 →CH 3 -CH 2 -CH 3 (kat = Ni, t 0);
— восстановление галогеналканов
C 2 H 5 I + HI →C 2 H 6 + I 2 (t 0);
— реакции щелочного плавления солей одноосновных органических кислот
C 2 H 5 -COONa + NaOH→ C 2 H 6 + Na 2 CO 3 (t 0);
— взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
2C 2 H 5 Br + 2Na → CH 3 -CH 2 -CH 2 -CH 3 + 2NaBr;
— электролиз солей одноосновных органических кислот
2C 2 H 5 COONa + 2H 2 O→H 2 + 2NaOH + C 4 H 10 + 2CO 2 ;
К(-): 2H 2 O + 2e → H 2 + 2OH — ;
A(+):2C 2 H 5 COO — -2e → 2C 2 H 5 COO + → 2C 2 H 5 + + 2CO 2 .
Химические свойства алканов
Алканы относятся к наименее реакционноспособным органическим соединениям, что объясняется их строением.
Алканы в обычных условиях не реагируют с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Для алканов наиболее характерны реакции, протекающие по радикальному механизму. Энергетически более выгоден гомолитический разрыв связей C-H и C-C, чем их гетеролитический разрыв.
Реакции радикального замещения наиболее легко протекают по третичному, дплее - по вторичному и в последнюю очередь по первичному атому углерода.
Все химические превращения алканов протекают с расщеплением:
1) cвязей C-H
— галогенирование (S R)
CH 4 + Cl 2 → CH 3 Cl + HCl (hv );
CH 3 -CH 2 -CH 3 + Br 2 → CH 3 -CHBr-CH 3 + HBr (hv ).
— нитрование (S R)
CH 3 -C(CH 3)H-CH 3 + HONO 2 (dilute) → CH 3 -C(NO 2)H-CH 3 + H 2 O (t 0).
— сульфохлорирование (S R)
R-H + SO 2 + Cl 2 → RSO 2 Cl + HCl (hv ).
— дегидрирование
CH 3 -CH 3 → CH 2 =CH 2 + H 2 (kat = Ni, t 0).
— дегидроциклизация
CH 3 (CH 2) 4 CH 3 → C 6 H 6 + 4H 2 (kat = Cr 2 O 3 , t 0).
2) связей C-H и C-C
— изомеризация (внутримолекулярная перегруппировка)
CH 3 -CH 2 -CH 2 -CH 3 →CH 3 -C(CH 3)H-CH 3 (kat=AlCl 3 , t 0).
— окисление
2CH 3 -CH 2 -CH 2 -CH 3 + 5O 2 → 4CH 3 COOH + 2H 2 O (t 0 , p);
C n H 2n+2 + (1,5n + 0,5)O 2 → nCO 2 + (n+1) H 2 O (t 0).
Применение алканов
Алканы нашли применение в различных отраслях промышленности. Рассмотрим подробнее, на примере некоторых представителей гомологического ряда, а также смесей алканов.
Метан составляет сырьевую основу важнейших химических промышленных процессов получения углерода и водорода, ацетилена, кислородсодержащих органических соединений - спиртов, альдегидов, кислот. Пропан применяется как автомобильное топливо. Бутан используется для получения бутадиена, являющегося сырьем для производства синтетического каучука.
Смесь жидких и твердых алканов до С 25 , называемая вазелином применяется в медицине как основа мазей. Смесь твердых алканов С 18 - С 25 (парафин) применяется для пропитки различных материалов (бумага, ткани, древесина) для придания им гидрофобных свойств, т.е. несмачиваемости водой. В медицине используется для физиотерапевтическихпроцедур (парафинолечение).
Примеры решения задач
ПРИМЕР 1
| Задание | При хлорировании метана получено 1,54 г соединения, плотность паров по воздуху которого равна 5,31. Рассчитайте массу диоксида марганца MnO 2 , которая потребуется для получения хлора, если соотношение объемов метана и хлора, введенных в реакцию равно 1:2. |
| Решение | Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Данная величина показывает, во сколько раз первый газ тяжелее или легче второго газа.
Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух - это смесь газов. Найдем молярную массу газа, образующегося при хлорировании метана: M gas = 29 ×D air (gas) = 29 × 5,31 = 154 г/моль. Это тетрахлорметан - CCl 4 . Запишем уравнение реакции и расставим стехиометрические коэффициенты: CH 4 + 4Cl 2 = CCl 4 + 4HCl. Рассчитаем количество вещества тетрахлорметана: n(CCl 4) = m(CCl 4) / M(CCl 4); n(CCl 4) = 1,54 / 154 = 0,01 моль. Согласно уравнению реакции n(CCl 4) : n(CH 4) = 1: 1, значит n(CH 4) = n(CCl 4) = 0,01 моль. Тогда, количество вещества хлора должно быть равно n(Cl 2) = 2 × 4 n(CH 4), т.е. n(Cl 2) = 8 × 0,01 = 0,08 моль. Запишем уравнение реакции получения хлора: MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O. Число моль диоксида марганца равно 0,08 моль, т.к. n(Cl 2) :n(MnO 2) = 1: 1. Найдем массу диоксида марганца: m(MnO 2) = n(MnO 2) ×M(MnO 2); M(MnO 2) = Ar(Mn) + 2×Ar(O) = 55 + 2×16 = 87 г/моль; m(MnO 2) = 0,08 × 87 = 10,4 г. |
| Ответ | Масса диоксида марганца равна 10,4 г. |
ПРИМЕР 2
| Задание | Установите молекулярную формулу трихлоралкана, массовая доля хлора в котором составляет 72,20%. Составьте структурные формулы всех возможных изомеров и дайте названия веществ по заместительной номенклатуре ИЮПАК. | ||||||
| Ответ | Запишем общую формулу трихлоралкеана:
C n H 2 n -1 Cl 3 . По формуле ω(Cl) = 3×Ar(Cl) / Mr(C n H 2 n -1 Cl 3) × 100% рассчитаем молекулярную массу трихлоралкана: Mr(C n H 2 n -1 Cl 3) = 3 × 35,5 / 72,20 × 100% = 147,5. Найдем значение n: 12n + 2n - 1 + 35,5×3 = 147,5; Следовательно, формула трихлоралкана C 3 H 5 Cl 3 . Составим структурные формулы изомеров: 1,2,3-трихлорпропан (1), 1,1,2-трихлорпропан (2), 1,1,3-трихлорпропан (3), 1,1,1-трихлорпропан (4) и 1,2,2-трихлорпропан (5). CH 2 Cl-CHCl-CH 2 Cl (1); CHCl 2 -CHCl-CH 3 (2); CHCl 2 -CH 2 -CH 2 Cl (3); CCl 3 -CH 2 -CH 3 (4); ОПРЕДЕЛЕНИЕ Алканы – предельные (алифатические) углеводороды, состав которых выражается формулой C n H 2 n +2 . Алканы образуют гомологический ряд, каждое химическое соединение которого по составу отличается от последующего и предыдущего на одинаковое число атомов углерода и водорода – CH 2 , а вещества, входящие в гомологический ряд, называются гомологами. Гомологический ряд алканов представлен в таблице 1. Таблица 1. Гомологический ряд алканов. В молекулах алканов выделяют первичные (т.е. связанные одной связью), вторичные (т.е. связанные двумя связями), третичные (т.е. связанные тремя связями) и четвертичные (т.е. связанные четырьмя связями) атомы углерода. C 1 H3 – C 2 H 2 – C 1 H 3 (1 – первичные, 2- вторичные атомы углерода) CH 3 –C 3 H(CH 3) – CH 3 (3- третичный атом углерода) CH 3 – C 4 (CH 3) 3 – CH 3 (4- четвертичный атом углерода) Для алканов характерна структурная изомерия (изомерия углеродного скелета). Так, у пентана имеются следующие изомеры: CH 3 -CH 2 -CH 2 -CH 2 -CH 3 (пентан) CH 3 –CH(CH 3)-CH 2 -CH 3 (2-метилбутан) CH 3 -C(CH 3) 2 -CH 3 (2,2 – диметилпропан) Для алканов, начиная с гептана, характерна оптическая изомерия. Атомы углерода в предельных углеводородах находятся в sp 3 –гибридизации. Углы между связями в молекулах алканов 109,5. Химические свойства алкановПри обычных условиях алканы химически инертны — не реагируют ни с кислотами, ни со щелочами. Это объясняется высокой прочностью -связей С-С и С-Н. Неполярные связи С-С и С-Н способны расщепляться только гомолитически под действием активных свободных радикалов. Поэтому алканы вступают в реакции, протекающие по механизму радикального замещения. При радикальных реакция в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода. Реакции радикального замещения имеют цепной характер. Основные стадии: зарождение (инициирование) цепи (1) – происходит под действием УФ-излучения и приводит к образованию свободных радикалов, рост цепи (2) – происходит за счет отрыва атома водорода от молекулы алкана; обрыв цепи (3) – происходит при столкновении двух одинаковых или разных радикалов. X:X → 2X . (1) R:H + X . → HX + R . (2) R . + X:X → R:X + X . (2) R . + R . → R:R (3) R . + X . → R:X (3) X . + X . → X:X (3) Галогенирование. При взаимодействии алканов с хлором и бромом при действии УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов: CH 3 Cl +Cl 2 = CH 2 Cl 2 + HCl (дихлорметан) CH 2 Cl 2 +Cl 2 = CHCl 3 + HCl (трихлорметан) CHCl 3 +Cl 2 = CCl 4 + HCl (тетрахлорметан) Нитрование (реакция Коновалова) . При действии разбавленной азотной кислоты на алканы при 140С и небольшом давлении протекает радикальная реакция: CH 3 -CH 3 +HNO 3 = CH 3 -CH 2 -NO 2 (нитроэтан) + H 2 O Сульфохлорирование и сульфоокисление. Прямое сульфирование алканов протекает с трудом и чаще всего сопровождается окислением, в результате чего образуются алкансульфонилхлориды: R-H + SO 2 + Cl 2 → R-SO 3 Cl + HCl Реакция сульфоокисления протекает аналогично, только в этом случае образуются алкансульфоновые кислоты: R-H + SO 2 + ½ O 2 → R-SO 3 H Крекинг – радикальный разрыв связей С-С. Протекает при нагревании и в присутствии катализаторов. При крекинге высших алканов образуются алкены, при крекинге метана и этана образуется ацетилен: С 8 H 18 = C 4 H 10 (бутан)+ C 3 H 8 (пропан) 2CH 4 = C 2 H 2 (ацетилен) + 3H 2 Окисление . При мягком окислении метана кислородом воздуха могут быть получены метанол, муравьиный альдегид или муравьиная кислота. На воздухе алканы сгорают до углекислого газа и воды: C n H 2 n +2 + (3n+1)/2 O 2 = nCO 2 + (n+1)H 2 O Физические свойства алкановПри обычных условиях С 1 -С 4 – газы, С 5 -С 17 – жидкости, начиная с С 18 – твердые вещества. Алканы практически нерастворимы в воде, но, хорошо растворимы в неполярных растворителях, например, в бензоле. Так, метан СН 4 (болотный, рудничий газ) – газ без цвета и запаха, хорошо растворимый в этаноле, эфире, углеводородах, но плохо растворимый в воде. Метан используют в качестве высококалорийного топлива в составе природного газа, в качестве сырья для производства водорода, ацетилена, хлороформа и других органических веществ в промышленных масштабах. Пропан С 3 Н 8 и бутан С 4 Н 10 – газы, применяемые в быту, в качестве балонных газов, за счет легкой сжижаемости. Пропан используется в качестве автомобильного топлива, поскольку является более экологически чистым, чем бензин. Бутан – сырье для получения 1,3 –бутадиена, использующегося в производстве синтетического каучука. Получение алкановАлканы получают из природных источников – природного газа (80-90% — метан, 2-3% — этан и другие предельные углеводороды), угля, торфа, древесины, нефти и горного воска. Выделяют лабораторные и промышленные способы получения алканов. В промышленности алканы получают из битумного угля (1) или по реакции Фишера-Тропша (2): nC + (n+1)H 2 = C n H 2 n +2 (1) nCO + (2n+1)H 2 = C n H 2 n +2 + H 2 O (2) К лабораторным способам получения алканов относят: гидрирование непредельных углеводородов при нагревании и в присутствии катализаторов (Ni, Pt, Pd) (1), взаимодействием воды с металлоорганическими соединениями (2), электролизом карбоновых кислот (3), по реакциям декарбоксилирования (4) и Вюрца (5) и другими способами. R 1 -C≡C-R 2 (алкин) → R 1 -CH = CH-R 2 (алкен) → R 1 -CH 2 – CH 2 -R 2 (алкан) (1) R-Cl + Mg → R-Mg-Cl + H 2 O → R-H (алкан) + Mg(OH)Cl (2) CH 3 COONa↔ CH 3 COO — + Na + 2CH 3 COO — → 2CO 2 + C 2 H 6 (этан) (3) CH 3 COONa + NaOH → CH 4 + Na 2 CO 3 (4) R 1 -Cl +2Na +Cl-R 2 →2NaCl + R 1 -R 2 (5) Примеры решения задачПРИМЕР 1
|