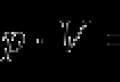Commencez par les sciences. Isotopes Application de radio-isotopes d'éléments non métalliques
>> Obtention d'isotopes radioactifs et leur utilisation
§ 112 OBTENTION DES ISOTOPES RADIOACTIFS ET LEUR APPLICATION
Dans l’industrie nucléaire, les isotopes radioactifs revêtent une valeur croissante pour l’humanité.
Des éléments qui n'existent pas dans la nature. Grâce aux réactions nucléaires, il est possible d'obtenir des isotopes radioactifs de tous les éléments chimiques présents dans la nature uniquement à l'état stable. Les éléments numérotés 43, 61, 85 et 87 n'ont aucun isotope stable et ont été obtenus artificiellement pour la première fois. Par exemple, l'élément portant le numéro de série Z - 43, appelé technétium, possède l'isotope à durée de vie la plus longue avec une demi-vie d'environ un million d'années.
Des éléments transuraniens ont également été obtenus à l'aide de réactions nucléaires. Vous connaissez déjà le neptunium et le plutonium. En plus d'eux, les éléments suivants ont également été obtenus : américium (Z = 95), curium (Z = 96), berkelium (Z = 97), californium (Z = 98), einsteinium (Z = 99), fermium (Z = 100), mendélévium (Z = 101), nobélium (Z = 102), lawrencium (Z = 103), rutherfordium (Z = 104), dubnium (Z = 105), seaborgium (Z = 106), bohrium (Z = 107) , hassium (Z = 108), meitnerium (Z = 109), ainsi que les éléments numérotés 110, 111 et 112, qui n'ont pas encore de noms généralement acceptés. Les éléments, commençant par le numéro 104, ont été synthétisés pour la première fois soit à Doubna près de Moscou, soit en Allemagne.
Atomes étiquetés. Actuellement, tant en science qu'en production, les isotopes radioactifs de divers éléments chimiques sont de plus en plus utilisés. La méthode la plus utilisée est la méthode des atomes marqués.
La méthode est basée sur le fait que les propriétés chimiques des isotopes radioactifs ne diffèrent pas des propriétés des isotopes non radioactifs des mêmes éléments.
Les isotopes radioactifs peuvent être détectés très simplement par leur rayonnement. La radioactivité est une sorte de marque avec laquelle vous pouvez surveiller le comportement d'un élément lors de diverses réactions chimiques et transformations physiques de substances. La méthode des atomes marqués est devenue l'une des méthodes les plus efficaces pour résoudre de nombreux problèmes en biologie, physiologie, médecine, etc.
Les isotopes radioactifs sont des sources de rayonnement. Les isotopes radioactifs sont largement utilisés en science, en médecine et en technologie comme sources compactes de rayons. Du cobalt radioactif est principalement utilisé.
Obtention d'isotopes radioactifs. Les isotopes radioactifs sont produits dans les réacteurs nucléaires et les accélérateurs de particules. Actuellement, une grande branche de l’industrie est impliquée dans la production d’isotopes.
Isotopes radioactifs en biologie et en médecine. L’une des études les plus remarquables réalisées à l’aide d’atomes marqués a été l’étude du métabolisme des organismes. Il a été prouvé qu'en un temps relativement court, le corps subit un renouvellement presque complet. Les atomes qui le composent sont remplacés par de nouveaux.
Seul le fer, comme l'ont montré des expériences sur les études isotopiques du sang, fait exception à cette règle. Le fer fait partie de l'hémoglobine des globules rouges. Lorsque des atomes de fer radioactifs ont été introduits dans les aliments, il a été constaté qu’ils ne pénétraient presque pas dans le sang. Ce n’est que lorsque les réserves de fer de l’organisme sont épuisées que celui-ci commence à absorber le fer.
S’il n’existe pas d’isotopes radioactifs à vie longue, comme ceux de l’oxygène et de l’azote, la composition isotopique des éléments stables est modifiée. Ainsi, en ajoutant un excès d’isotope à l’oxygène, il a été établi que l’oxygène libre libéré lors de la photosynthèse faisait à l’origine partie de l’eau et non du dioxyde de carbone.
Isotopes radioactifs utilisé en médecine à la fois à des fins diagnostiques et thérapeutiques.
Le sodium radioactif, injecté en petites quantités dans le sang, est utilisé pour étudier la circulation sanguine.
L'iode se dépose intensément dans la glande thyroïde, notamment dans la maladie de Basedow. En observant les dépôts d'iode radioactif à l'aide d'un compteur, un diagnostic peut être posé rapidement. De fortes doses d'iode radioactif provoquent une destruction partielle des tissus en développement anormal et c'est pourquoi l'iode radioactif est utilisé pour traiter la maladie de Basedow.
Un rayonnement intense au cobalt est utilisé dans le traitement du cancer (pistolet à cobalt).
Isotopes radioactifs dans l'industrie. Le domaine d'application des isotopes radioactifs dans l'industrie n'est pas moins vaste. Un exemple est la manière de surveiller l’usure des segments de piston dans les moteurs à combustion interne. En irradiant le segment de piston avec des neutrons, ils provoquent des réactions nucléaires et le rendent radioactif. Lorsque le moteur tourne, des particules de matériau annulaire pénètrent dans l'huile lubrifiante. En examinant le niveau de radioactivité dans l'huile après un certain temps de fonctionnement du moteur, l'usure des segments est déterminée.
Les isotopes radioactifs permettent de juger de la diffusion des métaux, des processus dans les hauts fourneaux, etc. Le puissant rayonnement des médicaments radioactifs est utilisé pour étudier la structure interne des pièces moulées métalliques afin d'en détecter les défauts.
Isotopes radioactifs en agriculture. Les isotopes radioactifs sont de plus en plus utilisés en agriculture. L'irradiation des graines de plantes (coton, chou, radis, etc.) avec de petites doses de rayons radioactifs entraîne une augmentation notable du rendement.
De fortes doses de rayonnement provoquent des mutations chez les plantes et les micro-organismes, ce qui conduit dans certains cas à l'apparition de mutants dotés de nouvelles propriétés intéressantes (radiosélection). C'est ainsi que de précieuses variétés de blé, de haricots et d'autres cultures ont été développées et que des micro-organismes hautement productifs utilisés dans la production d'antibiotiques ont été obtenus. Le rayonnement gamma des isotopes radioactifs est également utilisé pour lutter contre les insectes nuisibles et pour la conservation des aliments.
Les atomes marqués sont largement utilisés dans la technologie agricole. Par exemple, pour savoir quel engrais phosphoré est le mieux absorbé par la plante, divers engrais sont marqués au phosphore radioactif CR. En examinant la radioactivité des plantes, il est possible de déterminer la quantité de phosphore qu’elles ont absorbée provenant de différents types d’engrais.
Isotopes radioactifs en archéologie. La méthode du carbone radioactif a reçu une application intéressante pour déterminer l'âge d'objets anciens d'origine organique (bois, charbon de bois, tissus, etc.). Les plantes contiennent toujours un isotope radioactif du carbone avec une demi-vie T = 5 700 ans. Il se forme dans l'atmosphère terrestre en petites quantités à partir de l'azote sous l'influence des neutrons. Ces derniers résultent de réactions nucléaires provoquées par des particules rapides entrant dans l’atmosphère depuis l’espace (rayons cosmiques).
En se combinant avec l'oxygène, cet isotope du carbone forme du dioxyde de carbone, qui est absorbé par les plantes et, à travers elles, par les animaux. Un gramme de carbone provenant de jeunes échantillons de forêts émet une quinzaine de particules par seconde.
Après la mort de l'organisme, sa reconstitution en carbone radioactif s'arrête. La quantité disponible de cet isotope diminue en raison de la radioactivité. En déterminant le pourcentage de carbone radioactif dans les restes organiques, on peut déterminer leur âge s'il est compris entre 1 000 et 50 000, voire jusqu'à 100 000 ans. Cette méthode permet de déterminer l’âge des momies égyptiennes, des restes d’incendies préhistoriques, etc.
Les isotopes radioactifs sont largement utilisés en biologie, en médecine, dans l’industrie, l’agriculture et même en archéologie.
Que sont les isotopes radioactifs et comment sont-ils utilisés ?
Myakishev G. Ya., Physique. 11e année : pédagogique. pour l'enseignement général institutions : base et profil. niveaux / G. Ya. Myakishev, B. V. Bukhovtsev, V. M. Charugin ; édité par V. I. Nikolaeva, N. A. Parfentieva. - 17e éd., révisée. et supplémentaire - M. : Éducation, 2008. - 399 p. : ill.
Planification de la physique, téléchargement de matériel de physique de 11e année, manuels en ligne
Contenu de la leçon notes de cours cadre de support présentation de cours méthodes d'accélération technologies interactives Pratique tâches et exercices ateliers d'autotest, formations, cas, quêtes devoirs questions de discussion questions rhétoriques des étudiants Illustrations audio, clips vidéo et multimédia photographies, images, graphiques, tableaux, diagrammes, humour, anecdotes, blagues, bandes dessinées, paraboles, dictons, mots croisés, citations Modules complémentaires résumés articles astuces pour les curieux crèches manuels scolaires dictionnaire de base et supplémentaire des termes autres Améliorer les manuels et les leçonscorriger les erreurs dans le manuel mise à jour d'un fragment dans un manuel, éléments d'innovation dans la leçon, remplacement des connaissances obsolètes par de nouvelles Uniquement pour les enseignants des leçons parfaites plan de calendrier pour l'année; recommandations méthodologiques; programmes de discussion Leçons intégréesLes substances radioactives naturelles ont un nombre élevé de nucléons. Il est possible de créer des substances radioactives artificielles en bombardant des nucléides plus légers avec des particules alpha, des protons ou des neutrons. Les substances ainsi formées sont appelées radio-isotopes.
Note.
Un nucléide est tout noyau spécifique qui possède un certain nombre de protons et, par conséquent, de nucléons. Différents nucléides qui ont le même nombre de protons (mais des nombres de nucléons différents) sont appelés isotopes(nucléides isotopiques).
Le premier radio-isotope était un isotope instable du phosphore. Il a été obtenu en 1934 en bombardant de l'aluminium avec des particules alpha :
2 4 He + 13 27 Al= 15 30 P+ 0 1 n
À la suite de la réaction, du phosphore 30 et un neutron se forment. Notez que de chaque côté de l'équation, la somme des nombres de nucléons est 31 et la somme des nombres de protons est 15. Le phosphore-30 se désintègre, émettant positron, et a une demi-vie d'environ 3 minutes.
Le positron n’a pas été mentionné précédemment car il n’est pas présent dans la radioactivité naturelle. Il a une masse égale à la masse de l’électron et une charge positive, égale et opposée à la charge de l’électron. Il est désigné comme Che.
Lorsque le magnésium est bombardé par des neutrons, un radio-isotope du sodium se forme. La réaction suivante se produit :
12 24 Mg+ 0 1 n= 11 24 Na+ 1 1 H
Le sodium se désintègre en émettant une particule b :
11 24 Na- -1 0 e= 12 24 Mg
Vous pouvez vous familiariser en détail avec la technologie de production de radio-isotopes dans d'autres publications. Il est seulement important de noter qu'à l'heure actuelle, il est possible de synthétiser n'importe quel radio-isotope. La plupart d’entre eux ont des demi-vies courtes. Ce très important, car leur activité et, par conséquent, le danger de leur rayonnement radioactif ne sont pas de longue durée.
Application de radio-isotopes
Tous les isotopes d'une substance donnée ont les mêmes propriétés chimiques et se comportent de la même manière. L’avantage des radio-isotopes est que leur localisation peut être facilement détectée grâce au rayonnement qu’ils émettent.
Les radio-isotopes peuvent également être utilisés pour déterminer le degré d’usure des roulements. Si un radio-isotope est introduit dans un roulement, ses fines particules effacées de la surface et emportées avec l'huile seront radioactives. Si un échantillon de cette huile est testé pour la radioactivité, les résultats peuvent être utilisés pour vérifier le degré d'usure qui se produit.
Les fuites dans les tuyaux peuvent être détectées en ajoutant une petite quantité d’un radio-isotope au liquide qui les traverse. Pour trouver l'endroit où le radio-isotope fuit, un détecteur de rayonnement est utilisé.
Le cobalt 60 est un radionucléide instable dont la demi-vie est de 5,23 ans. Il est formé par bombardement de neutrons de cobalt-59 :
27 59 Co+ 0 1 n= 27 60 Co
Le cobalt 60 émet un rayonnement y de haute énergie. Il est utilisé dans le traitement du cancer à la place du rayonnement A' à haute énergie, difficile à obtenir. Il peut également être appliqué
pour détecter des fissures dans les soudures. La source de rayonnement doit être particulièrement bien protégée, mais son grand avantage par rapport à la source de rayons X est qu'elle est plus portable et ne nécessite pas de source d'alimentation.
Le phosphore radioactif P-32 et l'iode radioactif 131 sont des représentants de ces nombreux radionucléides artificiels utilisés pour détecter les dommages. Des mélanges contenant de petites quantités d'un isotope radioactif et d'un isotope stable sont utilisés pour retracer le passage de substances dans le tronc d'une plante, dans le corps des animaux et des humains. L'emplacement d'un isotope radioactif dans le corps peut être déterminé sans l'ouvrir ni le pénétrer par le rayonnement émis. Cela vous permet de diagnostiquer l'état de certains organes internes sans intervention chirurgicale
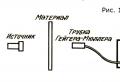
Les radio-isotopes sont largement utilisés dans l’industrie, par exemple pour vérifier si l’épaisseur du matériau produit est constante. Lorsque le matériau passe entre la source radioactive et le compteur, toute modification de son épaisseur entraîne une modification du taux de comptage (si l'épaisseur diminue, le taux de comptage augmente), et l'etr peut être enregistré (Fig. 1).

Isotopes radioactifs naturels
Il existe un petit nombre de radio-isotopes à faible nombre de protons qui se trouvent sous forme naturelle. Ils se forment à la suite d’un bombardement par des rayonnements spatiaux (rayons cosmiques). Le plus connu d’entre eux est le carbone 14 radioactif, qui se forme à partir de l’azote lorsqu’il est bombardé de neutrons :
7 14 N+ 0 1 n= 6 14 C+ 1 1 H
Le carbone 14 se désintègre en émettant une particule b et redevient de l'azote :
6 14 C- -1 0 e= 7 14 N
Le carbone 14 a une longue demi-vie, environ 5 600 ans. Il convient de noter qu’il existe un équilibre entre le niveau de formation de carbone 14 dans l’atmosphère et le niveau de sa désintégration, et que sa quantité dans l’atmosphère est constante. Une partie est absorbée par les plantes et les animaux. Lorsqu’une plante ou un animal meurt, il ne consomme plus de carbone et le carbone 14 qu’il contenait se désintègre. Ainsi, l’heure à laquelle une créature est morte peut être déterminée par l’activité du carbone 14 qu’elle contient. La datation au carbone est ainsi devenue une méthode de travail importante pour les archéologues et les anthropologues.
9. Application des isotopes radioactifs
L’une des études les plus remarquables réalisées à l’aide d’« atomes marqués » a été l’étude du métabolisme des organismes. Il a été prouvé qu'en un temps relativement court, le corps subit un renouvellement presque complet. Les atomes qui le composent sont remplacés par de nouveaux. Seul le fer, comme l'ont montré des expériences sur les études isotopiques du sang, fait exception à cette règle. Le fer fait partie de l’hémoglobine des globules rouges. Lorsque des atomes de fer radioactifs ont été introduits dans les aliments, il a été découvert que l’oxygène libre libéré lors de la photosynthèse faisait à l’origine partie de l’eau et non du dioxyde de carbone. Les isotopes radioactifs sont utilisés en médecine à la fois à des fins diagnostiques et thérapeutiques. Le sodium radioactif, injecté en petites quantités dans le sang, est utilisé pour étudier la circulation sanguine ; l'iode se dépose intensément dans la glande thyroïde, notamment dans la maladie de Basedow. En observant les dépôts d'iode radioactif à l'aide d'un compteur, un diagnostic peut être posé rapidement. De fortes doses d'iode radioactif provoquent une destruction partielle des tissus en développement anormal et c'est pourquoi l'iode radioactif est utilisé pour traiter la maladie de Basedow. Un rayonnement gamma intense au cobalt est utilisé dans le traitement du cancer (pistolet à cobalt).
Les applications des isotopes radioactifs dans l'industrie ne sont pas moins étendues. Un exemple en est la méthode suivante pour surveiller l’usure des segments de piston dans les moteurs à combustion interne. En irradiant le segment de piston avec des neutrons, ils provoquent des réactions nucléaires et le rendent radioactif. Lorsque le moteur tourne, des particules de matériau annulaire pénètrent dans l'huile lubrifiante. En examinant le niveau de radioactivité dans l'huile après un certain temps de fonctionnement du moteur, l'usure des segments est déterminée. Les isotopes radioactifs permettent de juger de la diffusion des métaux, des processus dans les hauts fourneaux, etc.
Un puissant rayonnement gamma provenant de médicaments radioactifs est utilisé pour examiner la structure interne des pièces moulées en métal afin d'en détecter les défauts.
Les isotopes radioactifs sont de plus en plus utilisés en agriculture. L'irradiation des graines de plantes (coton, chou, radis, etc.) avec de petites doses de rayons gamma provenant de médicaments radioactifs entraîne une augmentation notable du rendement. De fortes doses de rayonnement provoquent des mutations chez les plantes et les micro-organismes, ce qui conduit dans certains cas à l'apparition de mutants dotés de nouvelles propriétés intéressantes (radiosélection). C'est ainsi que de précieuses variétés de blé, de haricots et d'autres cultures ont été développées et que des micro-organismes hautement productifs utilisés dans la production d'antibiotiques ont été obtenus. Le rayonnement gamma des isotopes radioactifs est également utilisé pour lutter contre les insectes nuisibles et pour la conservation des aliments. Les « atomes marqués » sont largement utilisés dans la technologie agricole. Par exemple, pour savoir quel engrais phosphoré est le mieux absorbé par la plante, divers engrais sont étiquetés au phosphore radioactif 15 32P. En examinant ensuite la radioactivité des plantes, il est possible de déterminer la quantité de phosphore qu’elles ont absorbée provenant de différents types d’engrais.
Une application intéressante de la radioactivité est la méthode de datation des découvertes archéologiques et géologiques par la concentration d'isotopes radioactifs. La méthode de datation la plus couramment utilisée est la datation au radiocarbone. Un isotope instable du carbone apparaît dans l'atmosphère en raison de réactions nucléaires provoquées par les rayons cosmiques. Un faible pourcentage de cet isotope se trouve dans l'air avec l'isotope stable régulier. Les plantes et autres organismes absorbent le carbone de l'air et accumulent les deux isotopes dans les mêmes proportions que dans l'air. Après la mort des plantes, elles cessent de consommer du carbone et l'isotope instable, suite à la désintégration β, se transforme progressivement en azote avec une demi-vie de 5 730 ans. En mesurant avec précision la concentration relative de carbone radioactif dans les restes d'organismes anciens, il est possible de déterminer l'heure de leur mort.
La tâche de mise en œuvre de la polymérisation par greffage du tétrafluoroéthylène
Le tétrafluoroéthylène est utilisé comme monomère dans la production de polytétrafluoroéthylène (téflon). La pièce en Téflon est appelée « platine plastique ». Le téflon est un polymère linéaire. Il n'y a pas de liaisons chimiques croisées...
Les sources de rayonnement radioactif sont divisées en sources fermées et ouvertes. Fermé - doit être hermétique. Ouvert : toute source de rayonnement qui fuit et qui peut créer une contamination radioactive de l'air, de l'équipement...
Méthodes d'analyse basées sur la radioactivité
La méthode est basée sur la précipitation des ions de l'élément déterminé sous la forme d'un précipité insoluble avec un excès d'un précipitant (réactif) de concentration connue, marqué avec un isotope radioactif. L'activité spécifique du précipitant (réactif) doit être connue...
Méthodes d'analyse basées sur la radioactivité
De nombreux éléments chimiques sont radioactifs, c'est-à-dire tous leurs isotopes sont radioactifs. Il s’agit notamment du technétium, du prométhium et de tous les éléments naturels et artificiels qui apparaissent dans le tableau périodique des éléments après le bismuth. En plus...
Transformations des tungstate-antimonates de potassium et de césium
Les RW sont classés selon différents critères (Fig. 1) : par état d'agrégation, par composition (type) de rayonnement, par durée de vie (demi-vie T1/2), par activité spécifique (intensité du rayonnement). Cependant...
Application des isotopes radioactifs en technologie
Lorsque de puissantes sources de rayonnement sont apparues entre les mains des chercheurs, des millions de fois plus puissantes que l'uranium (il s'agissait de préparations de radium, de polonium, d'actinium), il a été possible de mieux connaître les propriétés des rayonnements radioactifs...
Mercure
La production mondiale de mercure au cours de la dernière décennie était d’environ 8 600 tonnes/an. Consommation de mercure (t/an) : b États-Unis -- 1800-2000 ; b Japon – 600-900 ; b Allemagne - 600 ; ь Italie - 550 ; b Espagne - 400 ; ь Grande-Bretagne - 350 ; ь France -- 300...
Propriétés et production de chlorure de calcium
Le chlorure de calcium est utilisé dans la production de chlorure de baryum, de certains colorants, pour la coagulation du latex, dans l'industrie chimique et pharmaceutique, dans le traitement des eaux usées, dans les systèmes de climatisation, dans l'extraction du pétrole, etc...
Propriétés et utilisations du calcium
Le calcium est de plus en plus utilisé dans diverses industries. Récemment, il a acquis une grande importance en tant qu'agent réducteur dans la préparation d'un certain nombre de métaux. Metal pur...
Propriétés du nitrate de calcium
1) Dans l'agriculture. Le nitrate de calcium est un engrais alcalin physiologique adapté à tous les sols et notamment aux sols acidifiés. En agriculture, il est utilisé comme engrais azoté...
Synthèse du bichromate d'ammonium
Un réactif de départ pratique pour obtenir de l'oxyde de chrome (III) de haute pureté (un pigment vert stable et partie intégrante de certains catalyseurs et un mélange bien connu pour le polissage de l'optique - la pâte GOI). En plus...
Analyse chromatographique de diverses classes de substances
De nombreux travaux sont consacrés à la séparation des isotopes d'autres éléments : néon, azote, oxygène, krypton et xénon. Cela vaut la peine de parler un peu des couples difficiles à séparer. L'utilisation de tamis moléculaires a résolu le problème de la séparation d'un mélange d'oxygène et d'azote...
Les isotopes sont des substances qui ont le même nombre de protons dans le noyau d'un atome, mais un nombre différent de neutrons.
Les isotopes ne sont pas inclus dans le tableau périodique car leurs propriétés ne diffèrent pratiquement pas de celles de la substance principale. En utilisant l'exemple d'un élément chimique tel que l'oxygène, expliquons - si un ou plusieurs neutrons sont ajoutés au noyau d'un atome d'oxygène à la suite d'une réaction nucléaire, alors l'oxygène restera toujours de l'oxygène, seulement ce sera un isotope d'oxygène.
Et si nous ajoutons un autre proton au noyau d'un atome d'oxygène, nous obtenons non pas un isotope, mais un autre élément chimique. Par exemple, le fluor - si nous ajoutons un proton, ou le néon, si nous ajoutons deux protons.
À l'heure actuelle, la science connaît plus de deux mille isotopes.
Les isotopes sont radioactifs, c'est-à-dire que les noyaux de leurs atomes sont instables et émettent des particules, ce qui signifie qu'ils se désintègrent. Mais certains isotopes radioactifs se désintègrent si lentement (des millions d’années) qu’ils peuvent aussi être considérés comme stables.
L’élément chimique hydrogène possède deux isotopes, et chacun d’eux a son propre nom. Aucun autre élément chimique ne possède d’isotopes portant leur propre nom.
Hydrogène ordinaire, ou aussi appelé protium.
Isotope de l'hydrogène à deux neutrons, il est appelé deutérium et est désigné par la lettre D. Le deutérium forme de l'eau lourde D 2 O.
Isotope de l'hydrogène à trois neutrons, il est appelé tritium et est désigné par la lettre T.
Les scientifiques ont découvert que dans chaque élément chimique présent dans la nature, son isotope est également présent en certaine quantité. Par exemple, l’hydrogène contient toujours environ 0,017 % de deutérium.
Application des isotopes en médecine.
À l'aide d'isotopes, le processus métabolique dans les organismes a été étudié. L’étude a été réalisée à l’aide d’« atomes marqués ». L’essence de la méthode est qu’une petite dose sûre d’isotopes est introduite dans le corps. De plus, les processus métaboliques sont étudiés en fonction de leur mouvement avec la substance principale. En médecine, les isotopes sont également utilisés à des fins de diagnostic et de thérapie.
Par exemple, l'isotope radioactif du sodium est utilisé pour étudier la circulation sanguine et l'iode radioactif est utilisé pour déterminer la maladie de Basedow, où il est nécessaire de surveiller les dépôts d'iode dans la glande thyroïde. Dans ce cas, la méthode de diagnostic et la thérapie sont les mêmes, puisque de fortes doses d'iode radioactif peuvent détruire partiellement les tissus en développement anormal. Et pour traiter le cancer, on utilise un rayonnement gamma au cobalt dur, également appelé pistolet à cobalt.
"Comment construire un système d'enseignement efficace"
Abonnez-vous maintenant - entrez votre e-mail
Les isotopes, en particulier les isotopes radioactifs, ont de nombreuses utilisations. Dans le tableau 1.13 fournit des exemples sélectionnés de certaines applications industrielles des isotopes. Chaque technique mentionnée dans ce tableau est également utilisée dans d'autres industries. Par exemple, la technique de détermination des fuites d'une substance à l'aide de radio-isotopes est utilisée : dans la production de boissons - pour déterminer les fuites des réservoirs de stockage et des canalisations ; dans la construction d'ouvrages d'art-Pour
Tableau 1.13. Quelques utilisations des radio-isotopes
Une mouche tsé-tsé mâle stérilisée avec une faible source de rayonnement radioactif est marquée pour une détection ultérieure (Burkina Faso). Cette procédure fait partie d'une expérience menée pour étudier la mouche tsé-tsé et établir des mesures de contrôle efficaces pour prévenir l'apparition généralisée de la trypanosomiase (maladie du sommeil). La mouche tsé-tsé est porteuse de cette maladie et infecte les humains, les animaux domestiques et le bétail sauvage. La maladie du sommeil est extrêmement courante dans certaines régions d’Afrique.
déterminer les fuites des conduites d'eau souterraines ; dans l'industrie énergétique - pour déterminer les fuites des échangeurs de chaleur dans les centrales électriques ; dans l'industrie pétrolière - pour déterminer les fuites des oléoducs souterrains ; dans le service de contrôle des eaux usées et des eaux usées - pour déterminer les fuites des égouts principaux.
Les isotopes sont également largement utilisés dans la recherche scientifique. Ils sont notamment utilisés pour déterminer les mécanismes des réactions chimiques. A titre d'exemple, nous soulignons l'utilisation de l'eau marquée avec l'isotope stable de l'oxygène 18O pour étudier l'hydrolyse d'esters comme l'acétate d'éthyle (voir également la section 19.3). En utilisant la spectrométrie de masse pour détecter l'isotope 18O, il a été constaté que lors de l'hydrolyse, un atome d'oxygène d'une molécule d'eau est transféré à l'acide acétique et non à l'éthanol.
Les radio-isotopes sont largement utilisés comme atomes marqués dans la recherche biologique. Afin de retracer les voies métaboliques* dans les systèmes vivants, les radio-isotopes carbone-14, tritium, phosphore-32 et soufre-35 sont utilisés. Par exemple, l’absorption du phosphore par les plantes provenant d’un sol traité avec des engrais peut être surveillée à l’aide d’engrais contenant un mélange de phosphore-32.
Radiothérapie. Les rayonnements ionisants peuvent détruire les tissus vivants. Les tissus tumoraux malins sont plus sensibles aux radiations que les tissus sains. Cela permet de traiter le cancer à l'aide de rayons Y émis par une source utilisant l'isotope radioactif cobalt-60. Le rayonnement est dirigé vers la zone du corps du patient touchée par la tumeur ; La séance de traitement dure quelques minutes et est répétée quotidiennement pendant 2 à 6 semaines. Pendant la séance, toutes les autres parties du corps du patient doivent être soigneusement recouvertes d'un matériau imperméable aux radiations afin d'éviter la destruction des tissus sains.
Détermination de l'âge des échantillons à l'aide du radiocarbone. Une petite partie du dioxyde de carbone présent dans l'atmosphère contient l'isotope radioactif "bC". Les plantes absorbent cet isotope lors de la photosynthèse. Par conséquent, les tissus de tous
* Le métabolisme est l'ensemble de toutes les réactions chimiques se produisant dans les cellules des organismes vivants. À la suite de réactions métaboliques, les nutriments sont convertis en énergie utile ou en composants cellulaires.. Les réactions métaboliques se produisent généralement en plusieurs étapes simples. La séquence de toutes les étapes d’une réaction métabolique est appelée voie métabolique (mécanisme).


Les radio-isotopes sont utilisés pour surveiller les mécanismes de dépôt de sédiments dans les estuaires, les ports et les quais.

Utilisation de radio-isotopes pour obtenir une image photographique d'une chambre de combustion d'un moteur à réaction à l'installation d'essais sans dommages de l'aéroport de Londres Heathrow. (Les affiches indiquent : Radiation. Restez à l'écart.) Les radio-isotopes sont largement utilisés dans l'industrie pour des tests non dommageables.
Les tissus vivants ont un niveau de radioactivité constant car sa diminution due à la désintégration radioactive est compensée par l'apport constant de radiocarbone provenant de l'atmosphère. Cependant, dès la mort d’une plante ou d’un animal, le flux de radiocarbone dans ses tissus s’arrête. Cela conduit à une diminution progressive du niveau de radioactivité dans les tissus morts.

La datation au radiocarbone a révélé que les échantillons de charbon de bois de Stonehenge ont environ 4 000 ans.
La méthode de géochronologie au radiocarbone a été développée en 1946 par l'U.F. Libby, qui a reçu pour cela le prix Nobel de chimie en 1960. Cette méthode est aujourd'hui largement utilisée par les archéologues, les anthropologues et les géologues pour dater des échantillons jusqu'à 35 000 ans. La précision de cette méthode est d'environ 300 ans. Les meilleurs résultats sont obtenus en déterminant l'âge de la laine, des graines, des coquilles et des os. Pour déterminer l'âge d'un échantillon, l'activité de rayonnement p (nombre de désintégrations par minute) est mesurée pour 1 g de carbone qu'il contient. Cela vous permet de déterminer l'âge de l'échantillon à l'aide de la courbe de désintégration radioactive de l'isotope 14C.

Quel âge ont la Terre et la Lune ?

De nombreuses roches sur Terre et sur la Lune contiennent des radio-isotopes dont la demi-vie est de l'ordre de 10-9 à 10-10 ans. En mesurant et en comparant l'abondance relative de ces radio-isotopes avec l'abondance relative de leurs produits de désintégration dans des échantillons de ces roches, leur âge peut être déterminé. Les trois méthodes géochronologiques les plus importantes sont basées sur la détermination de l'abondance relative des isotopes du K (demi-vie 1,4-109 ans). "Rb (demi-vie 6 1O10 ans) et 2I29U (demi-vie 4,50-109 ans).
Méthode de datation au potassium et à l'argon. Les minéraux tels que le mica et certains feldspaths contiennent de petites quantités de radio-isotope potassium-40. Il se désintègre en subissant une capture électronique et en se transformant en argon-40 :
![]()
L'âge d'un échantillon est déterminé sur la base de calculs utilisant des données sur la teneur relative en potassium 40 de l'échantillon par rapport à l'argon 40.
Méthode de datation du rubidium et du strontium. Certaines des roches les plus anciennes de la planète, comme les granites de la côte ouest du Groenland, contiennent du rubidium. Environ un tiers de tous les atomes de rubidium sont du rubidium-87 radioactif. Ce radio-isotope se désintègre en isotope stable strontium-87. Des calculs basés sur l'utilisation de données sur la teneur relative en isotopes du rubidium et du strontium dans les échantillons permettent de déterminer l'âge de ces roches.
Méthode de datation à l'uranium et au plomb. Les isotopes de l'uranium se désintègrent en isotopes du plomb. L'âge de minéraux tels que l'apatite, qui contiennent des impuretés d'uranium, peut être déterminé en comparant la teneur de certains isotopes d'uranium et de plomb dans leurs échantillons.
Les trois méthodes décrites ont été utilisées pour dater les roches terrestres. Les données obtenues indiquent que l'âge de la Terre est compris entre 4,6 et 109 ans. Ces méthodes ont également été utilisées pour déterminer l’âge des roches lunaires ramenées sur Terre lors de missions spatiales. L'âge de ces races varie de 3,2 à 4,2 *10 9 ans.
fission nucléaire et fusion nucléaire
Nous avons déjà mentionné que les valeurs expérimentales des masses isotopiques s'avèrent inférieures aux valeurs calculées comme la somme des masses de toutes les particules élémentaires incluses dans le noyau. La différence entre la masse atomique calculée et expérimentale est appelée défaut de masse. Le défaut de masse correspond à l'énergie nécessaire pour vaincre les forces répulsives entre particules de même charge dans le noyau atomique et les lier en un seul noyau ; c’est pour cette raison qu’on l’appelle énergie de liaison. L'énergie de liaison peut être calculée via le défaut de masse en utilisant l'équation d'Einstein
où E est l’énergie, m la masse et c la vitesse de la lumière.
L'énergie de liaison est généralement exprimée en mégaélectronvolts (1 MeV = 106 eV) par particule subnucléaire (nucléon). Un électron-volt est l'énergie qu'une particule avec une charge élémentaire unitaire (égale en valeur absolue à la charge d'un électron) gagne ou perd lorsqu'elle se déplace entre des points avec une différence de potentiel électrique de 1 V (1 MeV = 9,6 * 10 10 J /mole).
Par exemple, l’énergie de liaison par nucléon dans un noyau d’hélium est d’environ 7 MeV et dans un noyau de chlore 35, elle est de 8,5 MeV.
Plus l’énergie de liaison par nucléon est élevée, plus la stabilité du noyau est grande. En figue. La figure 1.33 montre la dépendance de l'énergie de liaison sur le nombre massique des éléments. Il convient de noter que les éléments les plus stables dont le nombre de masse est proche de 60. Ces éléments comprennent le 56Fe, le 59Co, le 59Ni et le 64Cu. Les éléments ayant des nombres de masse inférieurs peuvent, du moins d'un point de vue théorique, augmenter leur stabilité en augmentant leur nombre de masse. En pratique, cependant, il semble possible d’augmenter la masse massique uniquement des éléments les plus légers, comme l’hydrogène. (L'hélium a une stabilité anormalement élevée ; l'énergie de liaison des nucléons dans un noyau d'hélium ne correspond pas à la courbe représentée sur la figure 1.33.) Le nombre massique de ces éléments augmente dans un processus appelé fusion nucléaire (voir ci-dessous).