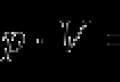Échelle de température thermodynamique de l'équation de Boltzmann. Échelle de température thermodynamique
Échelle de température thermodynamique (échelle Kelvin), une échelle de température absolue qui ne dépend pas des propriétés de la substance thermométrique (le point de référence est la température zéro absolue). La construction d'une échelle de température thermodynamique repose sur le deuxième principe de la thermodynamique et, en particulier, sur l'indépendance de l'efficacité du cycle de Carnot par rapport à la nature du fluide de travail. Unité de température thermodynamique - Kelvin (K)
Poids statistique et entropie.
L'entropie est une mesure du désordre d'un système composé de nombreux éléments dans les sciences naturelles. En particulier, en physique statistique, il s’agit d’une mesure de la probabilité d’apparition de tout état macroscopique.
Où est l'incrément d'entropie ; - chaleur minimale fournie au système ; - température absolue du procédé.
Poids statistique en thermodynamique et physique statistique- le nombre de façons dont un état macroscopique donné du système peut être réalisé. Le poids statistique est lié à l'entropie S du système par la relation de Boltzmann,
Où k = R/N = 1,38*10 -23 J/K
où k est la constante fondamentale de Boltzmann du monde ;
R = 8,31 J/(mol*K) - constante molaire des gaz ;
N = 6,06*10 23 mol -1 - Nombre d'Avogadro ;
P - poids statistique : le nombre de façons d'atteindre un état donné.
Le paramètre S - entropie - sert de mesure de la dissipation de l'énergie de l'Univers, et P - caractérise tout changement spontané ; cette valeur fait référence au monde des atomes qui déterminent le mécanisme caché du changement.
Billet
État d'équilibre. Diagrammes d'état. Équation d'état. Équation d'état des gaz raréfiés. Gaz parfait. Équation d'état des gaz non raréfiés (équation de van der Waals)
État d'équilibre- un état d'un système dans lequel les grandeurs macroscopiques de ce système (température, pression, volume, entropie) restent inchangées dans le temps dans des conditions d'isolement de l'environnement. En général, ces valeurs ne sont pas constantes, elles ne font que fluctuer (osciller) autour de leurs valeurs moyennes. Si un système à l’équilibre correspond à plusieurs états dans chacun desquels le système peut rester indéfiniment, alors le système est dit en équilibre métastable. Dans un état d'équilibre, il n'y a pas de flux de matière ou d'énergie dans le système, de potentiels hors équilibre (ou de forces motrices) ou de changements dans le nombre de phases présentes. Distinguer les équilibres thermiques, mécaniques, radiatifs (radiant) et chimiques.
1) l'équilibre est atteint dans n'importe quelle partie (ou parties) d'un système relativement grand - équilibre local,
2) un équilibre incomplet est atteint en raison de la différence dans les taux de processus de relaxation se produisant dans le système - équilibre partiel,
3) un équilibre local et partiel a lieu.
Dans les systèmes hors équilibre, des changements se produisent dans le flux de matière ou d'énergie ou, par exemple, dans les phases.
Diagrammes d'état.
diagramme d'équilibre, diagramme de phases, représentation graphique des états de phase d'équilibre de systèmes à un ou plusieurs composants à différentes valeurs des paramètres qui déterminent ces états. Les diagrammes de phases représentent la composition des phases d'un système à différentes concentrations de composants (X), températures (T) et pression (P).
Les diagrammes sont spatiaux. La dimension de l'espace dépend du nombre de variables indépendantes dont la fonction est la composition des phases. Un diagramme d’état peut être bidimensionnel, tridimensionnel ou multidimensionnel. Les variables (P, T, X) sont les coordonnées dans lesquelles le diagramme est construit. Chaque point du diagramme de phase (point figuratif) indique la composition de phase de la substance à des valeurs données de paramètres thermodynamiques (coordonnées de ce point). Lorsqu'un système se compose d'un seul composant, le diagramme de phases est une figure spatiale tridimensionnelle construite sur trois axes de coordonnées rectangulaires le long desquels la température (T), la pression (P) et le volume molaire (v) sont tracés. En pratique, une projection du diagramme de phase sur l'un des plans de coordonnées, généralement sur le plan P - T, est souvent utilisée.
Gaz raréfiés.
En physique, raréfié est un état de gaz dans lequel le libre parcours moyen des molécules dépasse les dimensions linéaires du récipient contenant le gaz. Cet état est aussi appelé vide. Le comportement des gaz raréfiés présente un certain nombre de caractéristiques. Étant donné que dans le vide, les molécules de gaz parcourent la distance d'une paroi à l'autre sans collision, il n'y a pas de pression d'une partie du gaz sur une autre ; on ne peut parler que de la pression du gaz sur les parois de la cuve. Dans les gaz raréfiés, il n'y a pas de frottement interne ni de phénomène de conductivité thermique au sens habituel. Le vide physique à température ambiante est réalisé dans des gaz à une pression inférieure à 10 -5 mm Hg. Art., si le gaz est dans un volume aux dimensions linéaires de l'ordre du mètre.
En technologie, le vide fait référence à l’état d’un gaz à une pression inférieure à la pression atmosphérique. Le degré de vide technique est évalué par la pression résiduelle du gaz.
Gaz parfait.
Le gaz parfait est un modèle mathématique du gaz dans lequel on suppose que :
1) l'énergie potentielle d'interaction des molécules peut être négligée par rapport à leur énergie cinétique ;
2) le volume total des molécules de gaz est négligeable ;
3) il n'y a pas de forces d'attraction ou de répulsion entre les molécules, les collisions des particules entre elles et avec les parois du récipient sont absolument élastiques ;
4) le temps d'interaction entre molécules est négligeable par rapport au temps moyen entre collisions.
Dans le modèle étendu d'un gaz parfait, les particules qui le composent se présentent sous la forme de sphères élastiques ou d'ellipsoïdes, ce qui permet de prendre en compte l'énergie non seulement du mouvement de translation, mais aussi de rotation-oscillatoire, ainsi que non seulement des collisions centrales, mais aussi non centrales de particules.
Équation d'état d'un gaz parfait (équation de Cliperon) ![]()
Équation d'état des gaz non raréfiés (équation de van der Waals)  ,
,
Billet.
Forme mécanique de transfert d’énergie vers le corps. Emploi. Forme thermique de transfert d’énergie vers le corps. Chaleur. La première loi de la thermodynamique. Travail d'équilibre effectué, apport de chaleur d'équilibre
Rappelons qu'en pratique, 0° est classiquement considéré comme la température de fonte de la glace à pression normale, et 100° est la température d'ébullition de l'eau à pression normale. Le centième de cette plage de température est l’unité pratique de température, les degrés Celsius (°C). Cependant, en divisant l'intervalle entre 0 °C et 100 °C en cent parties égales, les thermomètres à mercure et à alcool ont les mêmes valeurs qu'à 0 °C et à 100 °C. Par conséquent, la dilatation de ces substances lorsqu'elles sont chauffées se produit de manière inégale et il est impossible d'obtenir de cette manière une seule échelle de température.
Pour créer une échelle de température unifiée, vous devez disposer d'une valeur dont la mesure pendant le chauffage ou le refroidissement ne dépendrait pas du type de substance thermométrique. Cette valeur peut être la pression du gaz, puisque le coefficient de température et de pression pour des gaz pas trop denses ne dépend pas de la nature du gaz et a la même valeur que pour un gaz parfait. Le meilleur corps thermométrique serait un gaz parfait. Étant donné que les propriétés de l'hydrogène raréfié sont les plus proches de celles d'un gaz parfait, il est préférable de mesurer la température à l'aide d'un thermomètre à hydrogène, qui est un récipient fermé contenant de l'hydrogène raréfié connecté à un manomètre sensible. Puisque la pression et la température de l’hydrogène sont liées par la relation (4.3), la température peut être déterminée à partir de la lecture du manomètre.
L'échelle de température établie par un thermomètre à hydrogène, dans laquelle 0° correspond à la température de fonte de la glace et 100° à la température d'ébullition de l'eau, est appelée l'échelle Celsius.
Notez que le zéro sur l’échelle Celsius est défini de manière conditionnelle. La taille du diplôme est également déterminée arbitrairement. Cela signifie que, d’un point de vue scientifique, une construction différente de l’échelle de température est acceptable.
Un choix approprié d’échelle de température permet de simplifier les formules et de mieux comprendre la signification physique des modèles observés. À cette fin, à la suggestion de Kelvin, une nouvelle échelle de température a été introduite, désormais appelée échelle de température thermodynamique. On l'appelle parfois l'échelle Kelvin. Sur cette échelle, la température du zéro absolu est prise comme point de départ et la taille du degré est déterminée de manière à ce qu'elle coïncide le plus possible avec le degré Celsius.
En SI, l'unité de température est l'unité de base et s'appelle le kelvin, et l'échelle de température thermodynamique est utilisée pour mesurer la température.
Par accord international, la taille du kelvin est déterminée à partir de la condition suivante : la température du point triple de l'eau (§ 12.8) est considérée comme exactement égale à 273,16 K. Ainsi, si l'intervalle de température entre le zéro absolu et le triple La température ponctuelle de l'eau sur l'échelle d'un thermomètre à hydrogène est divisée en 273,16 parties, puis une de ces parties détermine la taille du kelvin. Puisque le point triple de l'eau correspond à la température, la température de fonte de la glace sur la nouvelle échelle sera de 273,15 K. Comme un kelvin a une valeur égale à un degré Celsius, le point d'ébullition de l'eau à pression normale sera de 373,15 K. pour simplifier, les températures de fusion et d'ébullition de la glace dans le futur, l'eau sera donc considérée comme égale à 273 et 373 K.
Le théorème de Carnot nous permet de construire une échelle de température totalement indépendante des caractéristiques individuelles de la substance thermométrique et de la conception du thermomètre. Cette échelle de température a été proposée par W. Thomson (Lord Kelvin) en 1848. Elle est construite comme suit. Laisser t 1 et t 2 températures du chauffage et du réfrigérateur mesurées avec une sorte de thermomètre. Alors, d’après le théorème de Carnot, l’efficacité du cycle de Carnot
Où F(t 1 ,t 2) – fonction universelle des températures empiriques sélectionnées t 1 et t 2. Son aspect est totalement indépendant de la conception spécifique de la machine Carnot et du type de substance de travail utilisée. À l’avenir, il sera plus pratique pour nous d’envisager une fonction de température universelle plus simple.
Cette fonction s’exprime facilement par F(t 1 ,t 2). Pour déterminer la forme générale de la fonction j( t 1 ,t 2), considérons trois réservoirs thermiques dont les températures sont maintenues constantes. Nous désignons les températures empiriques de ces réservoirs t 1 , t 2 , t 3 respectivement. En les utilisant comme radiateurs et réfrigérateurs, nous effectuerons trois cycles de Carnot ( a B c d, d-c-e-f, a-b-e-f) montré sur la fig. 11.1.
 Parallèlement, les températures sur les isothermes un B, d-c, f-eégal t 1 , t 2 , t 3, et les valeurs absolues des chaleurs obtenues sur les isothermes sont égales Q 1 , Q 2 , Q 3 respectivement. Pour les cycles a B c d Et d-c-e-f tu peux écrire
Parallèlement, les températures sur les isothermes un B, d-c, f-eégal t 1 , t 2 , t 3, et les valeurs absolues des chaleurs obtenues sur les isothermes sont égales Q 1 , Q 2 , Q 3 respectivement. Pour les cycles a B c d Et d-c-e-f tu peux écrire
Hors d'ici Q 2, on obtient
 .
.
Combinés ensemble, ces deux cycles équivalent à un cycle Carnot a-b-e-f, parce que isotherme CD est parcouru deux fois dans des directions opposées et peut être exclu de la considération. Ainsi,
En comparant cette expression avec la précédente, on obtient
Puisque le côté droit ne dépend pas de t 2, alors cette relation peut être satisfaite pour n'importe quelle valeur des arguments t 1 , t 2 , t 3 seulement si la fonction j( t 1 ,t 2) a la forme
 .
.
Ainsi j( t 1 ,t 2) est le rapport des valeurs d'une même fonction Q( t) à t = t 1 et t = t 2. Puisque la quantité Q( t) dépend uniquement de la température ; elle peut elle-même être considérée comme une mesure de la température corporelle. La quantité Q est appelée température thermodynamique absolue. Le rapport de deux températures thermodynamiques Q 1 et Q 2 est déterminé par la relation
Alors l’efficacité du cycle de Carnot peut s’écrire
 . (11.2)
. (11.2)
En comparant l'expression (11.2) avec l'efficacité du cycle de Carnot pour un gaz parfait (8.2), on peut vérifier que les rapports des températures thermodynamiques et des gaz parfaits des réservoirs thermiques du cycle de Carnot coïncident.
Le rapport Q 1 /Q 2 peut en principe être trouvé expérimentalement. Pour ce faire, vous devez mesurer les valeurs absolues de la chaleur Q 1 et Q 2, que le fluide de travail reçoit dans le cycle Carnot à partir de réservoirs thermiques de températures Q 1 et Q 2. Cependant, les températures Q 1 et Q 2 elles-mêmes ne sont pas encore déterminées de manière unique par la valeur de ce rapport.
Pour déterminer sans ambiguïté la température thermodynamique absolue, il faut attribuer une certaine valeur Q à n'importe quel point de température, puis utiliser la relation (11.1) pour calculer la température de tout autre corps. En fonction de la précision avec laquelle il est possible de reproduire certaines températures caractéristiques, le point triple de l'eau a été choisi comme point de référence principal, c'est-à-dire température à laquelle la glace, l'eau et la vapeur d'eau sont en équilibre (pression R. tr = 4,58 mm. art. Art.). Cette température reçoit la valeur T tr = 273,16 K exactement. Cette valeur de la température de référence a été choisie afin d'assurer la coïncidence de la température thermodynamique avec la température des gaz parfaits dans les limites d'applicabilité de cette dernière.
L'échelle de température construite est appelée échelle de température thermodynamique absolue (échelle Kelvin).
La machine de Carnot ne permet de construire une échelle de température qu'en principe. Il ne convient pas aux mesures pratiques de température. Cependant, de nombreuses conséquences de la deuxième loi de la thermodynamique et du théorème de Carnot permettent de corriger les lectures de thermomètres réels, ramenant ces lectures à l'échelle thermodynamique absolue. À cette fin, vous pouvez utiliser n'importe quelle relation thermodynamique précise qui, en plus de la température T seules les quantités mesurables expérimentalement sont incluses.
Pouce. En considérant les méthodes de mesure de la température, nous avons constaté que de telles mesures posent de sérieuses difficultés. Cela réside dans le fait que les échelles de température établies à l'aide de différents corps thermométriques ne coïncident pas entre elles.
Mais nous connaissons maintenant une propriété totalement indépendante du type de substance et qui peut donc servir de propriété thermométrique impeccable pour établir une échelle de température. Cette propriété réside dans le fait que toute substance, si elle est utilisée comme fluide de travail dans un moteur thermique réversible, donne la même efficacité (bien sûr, aux mêmes températures du chauffage et du réfrigérateur).
Si le fluide de travail, quel qu'il soit, absorbe de la chaleur à température et transfère de la chaleur au réfrigérateur à température, alors la relation suivante est vraie :
![]()
Cette dernière relation, valable pour toute substance, permet d'utiliser la machine de Carnot comme une sorte de thermomètre. Certes, ce « thermomètre » permet de déterminer uniquement le rapport de deux températures et non les températures elles-mêmes. Mais si l'on accepte d'attribuer une certaine valeur numérique à l'une de ces températures ou de la sélectionner d'une manière ou d'une autre
la taille du degré, alors la température souhaitée sera déterminée.
De cette façon, on établira une échelle de température qui ne dépend pas du type de substance, c’est-à-dire une échelle physiquement parfaite.
Expliquons avec un exemple comment mesurer la température avec un « thermomètre » aussi inhabituel. Supposons que nous ayons besoin de mesurer la température d'un certain corps et que nous n'ayons à notre disposition aucun thermomètre, à l'exception d'une machine Carnot.
Prenons comme radiateur dans une machine de Carnot un réservoir de chaleur à la température d'ébullition de l'eau (nous ne mesurerons bien sûr pas cette température, puisque nous n'avons pas de thermomètre à cet effet), et comme réfrigérateur, un chauffe-eau. réservoir à la température de fonte des glaces (que nous ne mesurerons pas non plus pour la même raison). Convenons également que nous diviserons la différence de température entre le radiateur et le réfrigérateur en 100 parties (degrés) ; nous aurions pu choisir n’importe quel autre nombre, tout comme nous aurions pu choisir n’importe quel autre réservoir de chaleur. En plus de la machine de Carnot, nous aurons également besoin d'un calorimètre pour mesurer les quantités de chaleur. Après tout, dans le « thermomètre » de Carnot, le problème thermométrique se transforme en problème calorimétrique.
Réalisons maintenant un cycle de Carnot réversible entre le chauffage et le réfrigérateur que nous avons choisis, en utilisant n'importe quel fluide de travail (après tout, rien n'en dépend), et mesurons la quantité de chaleur Fiagr. reçue du radiateur et la quantité de chaleur transmise au réfrigérateur. Désignons par et les températures (encore inconnues) de l'eau bouillante, de la glace fondante et du corps étudié. On peut alors écrire :
![]()
On refait ensuite le cycle de Carnot, mais avec le corps étudié comme réfrigérateur et avec le même radiateur, ou, à l'inverse, avec le même réfrigérateur, mais avec le corps étudié comme radiateur. Après avoir mesuré à nouveau la chaleur reçue du radiateur, qui restera la même que dans la première expérience, et la chaleur donnée au réfrigérateur, nous pouvons à nouveau écrire la relation
![]()
On a donc deux équations (92.2) et (92.3) pour déterminer les trois quantités et Mais on peut,
de plus, écrivez la troisième équation qui détermine la taille du diplôme :
![]()
Ces trois équations suffisent pour déterminer la température souhaitée et les valeurs de Theat et Tcol.
Reste à ajouter que l'on pourrait faire tourner notre moteur thermique dans le sens inverse, pour qu'il fonctionne comme une machine frigorifique. Il faudrait alors mesurer la quantité de chaleur transférée du réfrigérateur au radiateur et la quantité de travail externe dépensé pour cela.
Bien entendu, personne n’a jamais mesuré la température d’une manière aussi inhabituelle, ce qui est également techniquement impossible. Mais cela n’est pas nécessaire, car l’échelle de température établie à l’aide de la machine de Carnot peut être reproduite à partir de n’importe quelle substance spécifique aux propriétés bien connues. Une telle substance est par exemple un gaz parfait, dont l’équation d’état est connue avec précision. Comme nous l'avons montré, la formule (92.1) est obtenue si un gaz parfait est utilisé comme fluide de travail dans une machine de Carnot. On peut montrer que les températures mesurées sur l'échelle d'un thermomètre à gaz, où la température est obtenue à partir de la formule
exactement la même que la température qui aurait été obtenue si l'expérience décrite ci-dessus avait été réalisée.
A noter qu'une échelle de température basée sur les propriétés d'une machine de Carnot réversible est appelée échelle de température thermodynamique. Elle a été proposée par Kelvin et donc les températures exprimées dans cette échelle sont mesurées en Kelvin.
Quant au zéro de l'échelle thermodynamique, il ressort clairement de la formule (80.12) que le zéro doit être la température à laquelle. Dans ce cas, le rendement de la machine de Carnot est égal à l'unité et, par conséquent, il ne peut y avoir de valeur inférieure. température, puisque k. . p.d. ne peut pas dépasser un.
Puisque l’échelle de température thermodynamique coïncide avec l’échelle d’un gaz parfait, le zéro de l’échelle Kelvin coïncide avec le zéro absolu de la température, que nous avons défini précédemment. Il convient cependant de noter que selon la deuxième loi de la thermodynamique, le rendement d'un moteur thermique ne peut jamais être égal à l'unité : la quantité de chaleur reçue du radiateur ne peut pas être entièrement convertie en travail mécanique. Le zéro absolu ne peut donc pas être atteint.
Détermination cinétique moléculaire
Mesure de température
Pour mesurer la température, un certain paramètre thermodynamique de la substance thermométrique est sélectionné. Une modification de ce paramètre est clairement associée à un changement de température.
En pratique, la température est mesurée à l'aide de
Unités de température et échelle
Puisque la température est l’énergie cinétique des molécules, il est clair qu’il est plus naturel de la mesurer en unités d’énergie (c’est-à-dire dans le système SI en joules). Cependant, la mesure de la température a commencé bien avant la création de la théorie de la cinétique moléculaire, de sorte que les échelles pratiques mesurent la température en unités conventionnelles - les degrés.
Échelle de température Kelvin
Le concept de température absolue a été introduit par W. Thomson (Kelvin), c'est pourquoi l'échelle de température absolue est appelée échelle Kelvin ou échelle de température thermodynamique. L'unité de température absolue est le kelvin (K).
L'échelle de température absolue est ainsi appelée parce que la mesure de l'état fondamental de la limite inférieure de température est le zéro absolu, c'est-à-dire la température la plus basse possible à laquelle il est en principe impossible d'extraire de l'énergie thermique d'une substance.
Le zéro absolu est défini comme 0 K, soit environ −273,15 °C.
L'échelle de température Kelvin est une échelle de température dans laquelle le point de départ est le zéro absolu.
Les échelles de température utilisées dans la vie quotidienne - Celsius et Fahrenheit (utilisées principalement aux États-Unis) - ne sont pas absolues et sont donc peu pratiques pour mener des expériences dans des conditions où la température descend en dessous du point de congélation de l'eau, c'est pourquoi la température doit être exprimée nombre négatif. Pour de tels cas, des échelles de température absolues ont été introduites.
L'une d'elles s'appelle l'échelle de Rankine et l'autre l'échelle thermodynamique absolue (échelle Kelvin) ; leurs températures sont mesurées respectivement en degrés Rankine (°Ra) et kelvins (K). Les deux échelles commencent à la température zéro absolue. Ils diffèrent en ce sens qu’un Kelvin est égal à un degré Celsius et qu’un degré Rankine est égal à un degré Fahrenheit.
Le point de congélation de l'eau à pression atmosphérique standard correspond à 273,15 K. Le nombre de degrés Celsius et de kelvins entre les points de congélation et d'ébullition de l'eau est le même et égal à 100. Par conséquent, les degrés Celsius sont convertis en kelvins en utilisant la formule K = °C + 273,15.
Celsius
Fahrenheit
En Angleterre et notamment aux USA, l'échelle Fahrenheit est utilisée. Zéro degré Celsius équivaut à 32 degrés Fahrenheit et un degré Fahrenheit équivaut à 5/9 degrés Celsius.
La définition actuelle de l'échelle Fahrenheit est la suivante : c'est une échelle de température dans laquelle 1 degré (1 °F) est égal à 1/180ème de la différence entre le point d'ébullition de l'eau et la température de fonte de la glace à pression atmosphérique, et le point de fusion de la glace est de +32 °F. La température sur l'échelle Fahrenheit est liée à la température sur l'échelle Celsius (t °C) par le rapport t °C = 5/9 (t °F - 32), 1 °F = 9/5 °C + 32. Proposé par G. Fahrenheit en 1724.
Énergie du mouvement thermique au zéro absolu
Lorsque la matière se refroidit, de nombreuses formes d’énergie thermique et leurs effets associés diminuent simultanément en ampleur. La matière passe d’un état moins ordonné à un état plus ordonné. Le gaz se transforme en liquide puis cristallise en solide (l'hélium reste à l'état liquide à pression atmosphérique même au zéro absolu). Le mouvement des atomes et des molécules ralentit, leur énergie cinétique diminue. La résistance de la plupart des métaux diminue en raison d'une diminution de la diffusion des électrons sur les atomes du réseau cristallin vibrant avec une amplitude plus faible. Ainsi, même au zéro absolu, les électrons de conduction se déplacent entre les atomes avec une vitesse de Fermi de l'ordre de 1x10 6 m/s.
La température à laquelle les particules de matière ont un minimum de mouvement, préservé uniquement grâce au mouvement de la mécanique quantique, est la température du zéro absolu (T = 0K).
La température zéro absolu ne peut pas être atteinte. La température la plus basse (450 ± 80) x 10 -12 K du condensat de Bose-Einstein des atomes de sodium a été obtenue en 2003 par des chercheurs du MIT. Dans ce cas, le pic du rayonnement thermique se situe dans la région de longueur d'onde de l'ordre de 6 400 km, soit approximativement le rayon de la Terre.
Température d'un point de vue thermodynamique
Il existe de nombreuses échelles de température différentes. La température était autrefois déterminée de manière très arbitraire. La température était mesurée par des marques placées à égale distance sur les parois du tube, dans lesquelles l'eau se dilatait lorsqu'elle était chauffée. Ensuite, ils ont décidé de mesurer la température et ont découvert que les distances en degrés n’étaient pas les mêmes. La thermodynamique donne une définition de la température qui ne dépend d'aucune propriété particulière de la substance.
Introduisons la fonction F(T) qui ne dépend pas des propriétés de la substance. De la thermodynamique, il s'ensuit que si un moteur thermique, absorbant une quantité de chaleur Q 1 à T 1 produit de la chaleur Q sà une température d'un degré, et l'autre voiture, ayant absorbé la chaleur Q 2 à T 2, produit la même chaleur Q sà une température d'un degré, alors la machine absorbant Q 1 à T 1 devrait à température T 2 générer de la chaleur Q 2 .
Bien sûr, entre la chaleur Q et la température T il y a de la dépendance et de la chaleur Q 1 doit être proportionnel Q s. Ainsi, chaque quantité de chaleur Q s, dégagée à une température d'un degré, correspond à la quantité de chaleur absorbée par la machine à une température T, égal Q s, multiplié par une fonction croissante F températures :
Q = Q s F(T)Puisque la fonction trouvée augmente avec la température, on peut considérer qu’elle mesure elle-même la température, à partir d’une température standard d’un degré. Cela signifie que vous pouvez connaître la température corporelle en déterminant la quantité de chaleur absorbée par un moteur thermique fonctionnant dans l'intervalle entre la température corporelle et la température d'un degré. La température ainsi obtenue est appelée température thermodynamique absolue et ne dépend pas des propriétés de la substance. Ainsi, pour un moteur thermique réversible, l’égalité suivante est vraie :
Pour un système dans lequel l'entropie Sça pourrait être une fonction S(E) son énergie E, la température thermodynamique est définie comme :
Température et rayonnement
À mesure que la température augmente, l’énergie émise par le corps chauffé augmente. L'énergie de rayonnement d'un corps absolument noir est décrite par la loi de Stefan-Boltzmann
Échelle de Réaumur
Proposé l'année par R. A. Réaumur, qui a décrit le thermomètre à alcool qu'il a inventé.
L'unité est le degré Réaumur (°R), 1 °R est égal à 1/80 de l'intervalle de température entre les points de référence - la température de fonte de la glace (0 °R) et le point d'ébullition de l'eau (80 °R)
1°R = 1,25°C.
Cette balance est aujourd'hui tombée en désuétude ; c'est en France, pays d'origine de l'auteur, qu'elle a survécu le plus longtemps.
Transitions à différentes échelles
Comparaison des échelles de température
| Description | Kelvin | Celsius | Fahrenheit | Classement | Délisle | Newton | Réaumur | Römer |
|---|---|---|---|---|---|---|---|---|
| Zéro absolu | 0 | −273.15 | −459.67 | 0 | 559.725 | −90.14 | −218.52 | −135.90 |
| Température de fusion du mélange Fahrenheit (sel et glace en quantités égales) | 255.37 | −17.78 | 0 | 459.67 | 176.67 | −5.87 | −14.22 | −1.83 |
| Point de congélation de l'eau (Conditions normales) | 273.15 | 0 | 32 | 491.67 | 150 | 0 | 0 | 7.5 |
| Température moyenne du corps humain¹ | 310.0 | 36.6 | 98.2 | 557.9 | 94.5 | 12.21 | 29.6 | 26.925 |
| Point d'ébullition de l'eau (Conditions normales) | 373.15 | 100 | 212 | 671.67 | 0 | 33 | 80 | 60 |
| Faire fondre le titane | 1941 | 1668 | 3034 | 3494 | −2352 | 550 | 1334 | 883 |
| Surface du Soleil | 5800 | 5526 | 9980 | 10440 | −8140 | 1823 | 4421 | 2909 |
¹ La température moyenne normale du corps humain est de 36,6 °C ±0,7 °C, ou 98,2 °F ±1,3 °F. La valeur communément donnée de 98,6 ° F est une conversion exacte en Fahrenheit de la valeur allemande de 37 ° C du 19e siècle. Cependant, cette valeur ne se situe pas dans la plage de température moyenne normale du corps humain, car la température de différentes parties du corps varie