Chromosomes des hommes et des femmes. Chromosomes
Les chromosomes sont les principaux éléments structurels du noyau cellulaire, qui sont porteurs de gènes dans lesquels l'information héréditaire est codée. Avec la capacité de se reproduire, les chromosomes fournissent un lien génétique entre les générations.
La morphologie des chromosomes est associée au degré de leur spiralisation. Par exemple, si au stade de l'interphase (voir Mitose, Méiose), les chromosomes sont dépliés au maximum, c'est-à-dire déspiralisés, alors avec le début de la division, les chromosomes sont intensément spiralés et raccourcis. La spiralisation et le raccourcissement maximum du chromosome sont obtenus au stade de la métaphase, lorsque des structures relativement courtes et denses se forment et sont intensément colorées avec des colorants basiques. Cette étape est la plus pratique pour étudier les caractéristiques morphologiques des chromosomes.
Le chromosome de la métaphase se compose de deux sous-unités longitudinales - les chromatides [révèlent dans la structure des chromosomes des filaments élémentaires (appelés chromonèmes, ou chromofibrilles) d'une épaisseur de 200 , chacun étant constitué de deux sous-unités].
Les tailles des chromosomes des plantes et des animaux varient considérablement : de quelques fractions de micron à des dizaines de microns. Les longueurs moyennes des chromosomes humains en métaphase sont de l'ordre de 1,5 à 10 microns.
La base chimique de la structure des chromosomes est constituée de nucléoprotéines - complexes (voir) avec des protéines basiques - histones et protamines.
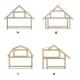
Riz. 1. La structure d'un chromosome normal.
A - apparence; B - structure interne : 1-constriction primaire ; 2 - rétrécissement secondaire; 3 - satellites; 4 - centromère.
Les chromosomes individuels (Fig. 1) se distinguent par la localisation de la constriction primaire, c'est-à-dire l'emplacement du centromère (au cours de la mitose et de la méiose, les fils du fuseau sont attachés à cet endroit, le tirant vers le pôle). Lorsque le centromère est perdu, les fragments de chromosomes perdent leur capacité à se séparer lors de la division. La constriction primaire divise les chromosomes en 2 bras. Selon l'emplacement de la constriction primaire, les chromosomes sont subdivisés en métacentriques (les deux bras de longueur égale ou presque égale), submétacentriques (bras de longueur inégale) et acrocentriques (le centromère est déplacé à la fin du chromosome). En plus du primaire, des constrictions secondaires moins prononcées peuvent être trouvées dans les chromosomes. Une petite section terminale de chromosomes, séparée par une constriction secondaire, s'appelle un satellite.
Chaque type d'organisme est caractérisé par son propre ensemble spécifique (en termes de nombre, de taille et de forme des chromosomes) appelé jeu de chromosomes. L'ensemble d'un ensemble de chromosomes doubles, ou diploïdes, est appelé caryotype.

Riz. 2. Ensemble de chromosomes normaux d'une femme (deux chromosomes X dans le coin inférieur droit).

Riz. 3. Ensemble de chromosomes normaux d'un homme (dans le coin inférieur droit - chromosomes X et Y consécutifs).
Les œufs matures contiennent un ensemble unique ou haploïde de chromosomes (n), qui est la moitié de l'ensemble diploïde (2n) inhérent aux chromosomes de toutes les autres cellules du corps. Dans un ensemble diploïde, chaque chromosome est représenté par une paire d'homologues, dont l'un est maternel et l'autre d'origine paternelle. Dans la plupart des cas, les chromosomes de chaque paire sont identiques en taille, forme et constitution génétique. L'exception concerne les chromosomes sexuels, dont la présence détermine le développement du corps dans le sens masculin ou féminin. L'ensemble de chromosomes humains normaux se compose de 22 paires d'autosomes et d'une paire de chromosomes sexuels. Chez l'homme et les autres mammifères, la femelle est déterminée par la présence de deux chromosomes X, et le mâle est déterminé par la présence d'un chromosome X et d'un chromosome Y (Fig. 2 et 3). Dans les cellules femelles, l'un des chromosomes X est génétiquement inactif et se trouve dans le noyau d'interphase sous la forme (voir). L'étude des chromosomes humains dans la santé et la maladie fait l'objet de la cytogénétique médicale. Il a été constaté que les écarts dans le nombre ou la structure des chromosomes par rapport à la norme qui se produisent dans l'appareil génital ! cellules ou dans les premiers stades du clivage d'un ovule fécondé, provoquent des perturbations dans le développement normal du corps, provoquant dans certains cas la survenue d'une partie d'avortements spontanés, de mortinaissances, de malformations congénitales et d'anomalies du développement après la naissance (maladies chromosomiques). Des exemples de maladies chromosomiques comprennent la maladie de Down (chromosome G supplémentaire), le syndrome de Klinefelter (chromosome X supplémentaire chez l'homme) et (absence d'un Y ou de l'un des chromosomes X dans le caryotype). En pratique médicale, l'analyse chromosomique est réalisée soit par une méthode directe (sur des cellules de moelle osseuse), soit après une culture à court terme de cellules à l'extérieur du corps (sang périphérique, peau, tissus embryonnaires).
Les chromosomes (du grec chroma - couleur et soma - corps) sont des éléments structurels filiformes et autoreproducteurs du noyau cellulaire, contenant dans un ordre linéaire les facteurs de l'hérédité - les gènes. Les chromosomes sont clairement visibles dans le noyau lors de la division des cellules somatiques (mitose) et lors de la division (maturation) des cellules sexuelles - méiose (Fig. 1). Dans les deux cas, les chromosomes sont intensément colorés avec des colorants basiques et sont également visibles sur des préparations cytologiques non colorées en contraste de phase. Dans le noyau interphasique, les chromosomes sont déspiralisés et non visibles au microscope optique, car leurs dimensions transversales dépassent la résolution d'un microscope optique. À ce stade, des sections individuelles de chromosomes sous forme de filaments minces d'un diamètre de 100 à 500 Å peuvent être distinguées à l'aide d'un microscope électronique. Des sections séparées non déspiralisées de chromosomes dans le noyau d'interphase sont visibles au microscope optique sous forme de sections à coloration intense (hétéropycnotiques) (chromocentres).
Les chromosomes existent en permanence dans le noyau cellulaire, subissant un cycle de spiralisation réversible : mitose-interphase-mitose. Les schémas de base de la structure et du comportement des chromosomes pendant la mitose, la méiose et la fécondation sont les mêmes dans tous les organismes.
Théorie chromosomique de l'hérédité... Pour la première fois, les chromosomes ont été décrits par I.D. Chistyakov en 1874 et E. Strasburger en 1879. En 1901, E.V. Wilson, et en 1902, WS Sutton a attiré l'attention sur le parallélisme du comportement des chromosomes et des facteurs mendéliens de l'hérédité - les gènes - dans méiose et pendant la fécondation et est arrivé à la conclusion que les gènes sont situés dans les chromosomes. En 1915-1920. Morgan (T. N. Morgan) et ses collègues ont prouvé cette position, localisé plusieurs centaines de gènes dans les chromosomes de la drosophile et créé des cartes génétiques des chromosomes. Les données sur les chromosomes obtenues dans le premier quart du 20e siècle ont constitué la base de la théorie chromosomique de l'hérédité, selon laquelle la continuité des caractéristiques des cellules et des organismes dans un certain nombre de leurs générations est assurée par la continuité de leurs chromosomes.
Composition chimique et autoreproduction des chromosomes... À la suite d'études cytochimiques et biochimiques des chromosomes dans les années 30 et 50 du 20e siècle, il a été établi qu'ils sont constitués de composants constants [ADN (voir Acides nucléiques), protéines basiques (histones ou protamines), protéines non histones] et des composants variables (ARN et protéine acide associée). Les chromosomes sont basés sur des filaments de désoxyribonucléoprotéines d'un diamètre d'environ 200 (Fig. 2), qui peuvent être combinés en faisceaux d'un diamètre de 500 A.
La découverte par Watson et Crick (JD Watson, FN Crick) en 1953 de la structure de la molécule d'ADN, du mécanisme de son autoreproduction (réduplication) et du code nucléique de l'ADN et le développement de la génétique moléculaire qui a émergé après cela a conduit au concept des gènes sous forme de sections de la molécule d'ADN. (voir Génétique). Les schémas d'autoreproduction des chromosomes ont été révélés [Taylor (J.N. Taylor) et al., 1957], qui se sont avérés similaires aux schémas d'autoreproduction des molécules d'ADN (réduplication semi-conservatrice).
Ensemble de chromosomes- l'ensemble de tous les chromosomes d'une cellule. Chaque espèce biologique possède un ensemble caractéristique et constant de chromosomes, fixé dans l'évolution de cette espèce. Il existe deux principaux types de jeux de chromosomes : simples ou haploïdes (dans les cellules germinales des animaux), désignés n, et doubles, ou diploïdes (dans les cellules somatiques, contenant des paires de chromosomes homologues similaires de la mère et du père), désignés 2n.
Les ensembles de chromosomes d'espèces biologiques individuelles diffèrent considérablement par le nombre de chromosomes : de 2 (ver rond du cheval) à des centaines et des milliers (certaines plantes à spores et protozoaires). Les nombres diploïdes de chromosomes de certains organismes sont les suivants : humains - 46, gorilles - 48, chats - 60, rats - 42, drosophiles - 8.
Les tailles des chromosomes dans différentes espèces sont également différentes. La longueur des chromosomes (dans la métaphase de la mitose) varie de 0,2 micron chez certaines espèces à 50 microns chez d'autres, et le diamètre est de 0,2 à 3 microns.
La morphologie chromosomique est bien exprimée dans la métaphase de la mitose. Ce sont les chromosomes en métaphase qui sont utilisés pour identifier les chromosomes. Dans de tels chromosomes, les deux chromatides sont clairement visibles, dans lesquelles chaque chromosome et centromère (kinétochore, constriction primaire), qui relie les chromatides, est divisé longitudinalement (Fig. 3). Le centromère est visible comme une zone rétrécie qui ne contient pas de chromatine (voir); des fils du fuseau d'achromatine y sont attachés, grâce auxquels le centromère détermine le mouvement des chromosomes vers les pôles lors de la mitose et de la méiose (Fig. 4).
La perte d'un centromère, par exemple, lorsqu'un chromosome est brisé par un rayonnement ionisant ou d'autres mutagènes, entraîne la perte de la capacité d'un morceau de chromosome dépourvu de centromère (fragment acentrique) à participer à la mitose et à la méiose et à sa perte du noyau. Cela peut gravement endommager la cellule.
Le centromère divise le corps chromosomique en deux bras. La localisation du centromère est strictement constante pour chaque chromosome et détermine trois types de chromosomes : 1) des chromosomes acrocentriques, ou en forme de bâtonnet, avec un bras long et un second très court, ressemblant à une tête ; 2) des chromosomes submétacentriques avec de longs bras de longueur inégale ; 3) des chromosomes métacentriques avec des bras de longueur identique ou presque égale (Fig. 3, 4, 5 et 7).

Riz. 4. Schéma de la structure des chromosomes dans la métaphase de la mitose après clivage longitudinal du centromère : A et A1 - chromatides sœurs ; 1 - épaule longue; 2 - épaule courte; 3 - rétrécissement secondaire; 4 - centromère; 5 - fibres de fuseau.
Les traits caractéristiques de la morphologie de certains chromosomes sont des constrictions secondaires (n'ayant pas la fonction d'un centromère), ainsi que des satellites - de petites sections de chromosomes reliées au reste de son corps par un fil mince (Fig. 5). Les filaments satellites ont la capacité de former des nucléoles. La structure caractéristique du chromosome (chromomères) est un épaississement ou des sections plus étroitement enroulées du filament chromosomique (chromonèmes). Le motif chromomère est spécifique à chaque paire de chromosomes.

Riz. 5. Schéma de la morphologie du chromosome dans l'anaphase de la mitose (chromatide. S'étendant jusqu'au pôle). A - l'apparition du chromosome; B - structure interne du même chromosome avec deux chromonèmes constitutifs (semi-chromatides) : 1 - constriction primaire avec des chromomères constituant les centromères ; 2 - rétrécissement secondaire; 3 - satellites; 4 - fil satellite.
Le nombre de chromosomes, leur taille et leur forme au stade de la métaphase sont caractéristiques de chaque type d'organisme. La combinaison de ces caractéristiques d'un ensemble de chromosomes s'appelle un caryotype. Le caryotype peut être considéré comme un diagramme appelé idiogramme (voir ci-dessous pour les chromosomes humains).
Chromosomes sexuels... Les gènes qui déterminent le sexe sont localisés dans une paire spéciale de chromosomes - les chromosomes sexuels (mammifères, humains); dans d'autres cas, l'iol est déterminé par le rapport du nombre de chromosomes sexuels et de tous les autres, appelés autosomes (Drosophila). Chez l'homme, comme chez les autres mammifères, le sexe féminin est déterminé par deux chromosomes identiques, appelés chromosomes X, le sexe masculin est déterminé par une paire de chromosomes hétéromorphes : X et Y. En raison de la division de réduction (méiose) au cours de l'ovocyte maturation (voir Ovogenèse) chez la femme, tous les ovules contiennent un chromosome X. Chez les hommes, en raison de la division de réduction (maturation) des spermatocytes, la moitié du sperme contient le chromosome X et l'autre moitié contient le chromosome Y. Le sexe d'un enfant est déterminé par la fécondation accidentelle d'un ovule avec un spermatozoïde porteur du chromosome X ou Y. Le résultat est un embryon femelle (XX) ou mâle (XY). Dans le noyau interphasique chez la femme, l'un des chromosomes X est visible sous la forme d'un bloc de chromatine sexuelle compacte.
Fonction chromosomique et métabolisme nucléaire... L'ADN chromosomique est un modèle pour la synthèse de molécules d'ARN messager spécifiques. Cette synthèse se produit lorsqu'une section donnée du chromosome est déspiralisée. Des exemples d'activation locale de chromosomes sont : la formation de boucles chromosomiques déspiralisées dans les ovocytes d'oiseaux, d'amphibiens, de poissons (les brosses dites à lampe X) et de renflements (bouffées) de certains loci chromosomiques dans les chromosomes multifilamenteux (polytènes) des glandes salivaires et d'autres organes sécrétoires des diptères (Fig. 6). Un exemple d'inactivation d'un chromosome entier, c'est-à-dire son exclusion du métabolisme d'une cellule donnée, est la formation de l'un des chromosomes X d'un corps compact de chromatine sexuelle.
Riz. 6. Chromosomes polytènes de l'insecte diptère Acriscotopus lucidus : A et B - la zone délimitée par des pointillés, en état de fonctionnement intensif (bouffée) ; B - la même section dans un état de non-fonctionnement. Les loci individuels des chromosomes (chromomères) sont désignés par des nombres.
Riz. 7. Chromosome fixé dans la culture de leucocytes mâles du sang périphérique (2n = 46).
Découvrir les mécanismes de fonctionnement des chromosomes polytènes tels que les balais de lampe et d'autres types de spiralisation et de déspiralisation des chromosomes est crucial pour comprendre l'activation différentielle réversible des gènes.
Chromosomes humains... En 1922, T. S. Painter établit le nombre diploïde de chromosomes humains (dans les spermatogonies), égal à 48. En 1956, Tio et Levan (H. J. Tjio, A. Levan) utilisèrent un ensemble de nouvelles méthodes pour étudier les chromosomes humains : culture cellulaire ; étude des chromosomes sans coupes histologiques sur des préparations cellulaires totales ; la colchicine, conduisant à l'arrêt de la mitose au stade métaphasique et à l'accumulation de ces métaphases ; la phytohémagglutinine, qui stimule l'entrée des cellules en mitose ; traitement des cellules en métaphase avec une solution saline hypotonique. Tout cela a permis de préciser le nombre diploïde de chromosomes chez l'homme (il s'est avéré être 46) et de donner une description du caryotype humain. En 1960, à Denver (USA), une commission internationale développa la nomenclature des chromosomes humains. Selon les propositions de la commission, le terme « caryotype » devrait être appliqué à l'ensemble systématisé de chromosomes d'une seule cellule (Fig. 7 et 8). Le terme « idiotrame » est retenu pour représenter un ensemble de chromosomes sous forme de schéma basé sur des mesures et une description de la morphologie des chromosomes de plusieurs cellules.
Les chromosomes humains sont numérotés (en partie en série) de 1 à 22 conformément aux caractéristiques morphologiques qui permettent leur identification. Les chromosomes sexuels n'ont pas de numéro et sont désignés par X et Y (Fig. 8).
Un lien a été trouvé entre un certain nombre de maladies et de malformations congénitales dans le développement humain avec des changements dans le nombre et la structure de ses chromosomes. (voir Hérédité).
Voir aussi Études cytogénétiques.
Toutes ces réalisations ont créé une base solide pour le développement de la cytogénétique humaine.
Riz. 1. Chromosomes : A - au stade de l'anaphase de la mitose dans les microsporocytes du trèfle ; B - au stade de la métaphase de la première division de la méiose dans les cellules polliniques maternelles près de Tradescantia. Dans les deux cas, la structure en spirale des chromosomes est visible.
Riz. 2. Filaments chromosomiques élémentaires d'un diamètre de 100 Å (ADN + histone) issus des noyaux interphasiques du thymus du veau (microscopie électronique) : A - filaments isolés des noyaux ; B - une section mince à travers un film de la même préparation.
Riz. 3. Ensemble chromosomique de Vicia faba (féverole) au stade de la métaphase.
Riz. 8. Chromosomes identiques à ceux de la fig. 7, kits classés selon la nomenclature de Denver en paires homologues (caryotype).
Comme vous le savez, dans l'écrasante majorité des pays, les hommes vivent nettement moins que les femmes. Divers rapports d'institutions médicales indiquent qu'une morbidité et une mortalité accrues sont observées chez les hommes pour presque toutes les maladies connues, à l'exception peut-être de certaines infections gonococciques et de la coqueluche. De plus, selon les zoologistes, ce déséquilibre de santé chez les mâles et les femelles ne se limite pas à la population humaine. Ainsi, selon l'une des études récentes à grande échelle, dans 62 des 70 espèces (89 %) ayant fait l'objet d'une analyse comparative (nématodes, mollusques, crustacés, insectes, arachnides, oiseaux, reptiles, poissons et, bien sûr, mammifères ), les mâles vivent moins que les femelles.
De tout ce qui a été dit, la conclusion s'impose : la mortalité accrue du sexe mâle est apparemment un phénomène universel dans la faune terrestre. Quelles sont les raisons de cette aversion pour mère nature chez les producteurs masculins ? À l'heure actuelle, de nombreuses théories scientifiques essayant de justifier ce phénomène biologique d'une manière ou d'une autre se sont déjà accumulées. Des tailles de mâles trop grandes et/ou leurs couleurs trop vives, ainsi qu'un risque accru de blessure - les mâles sont plus à risque du fait qu'ils sont responsables de la recherche de nourriture, de la protection du territoire, etc., ont été proposés comme explications possibles ; Le facteur métabolique joue également un rôle.
Cependant, en grande partie en raison du développement rapide de la génétique au cours des dernières décennies, la théorie dite du déséquilibre génétique a pris le devant de la scène. Comme le croient les partisans de cette théorie, la principale raison de la mortalité élevée des animaux mâles est leur constitution hétérogamétique, ou l'absence du deuxième chromosome X dans l'ensemble génétique de l'organisme mâle (pour plus de détails, voir "XY et XX") .
En d'autres termes, puisque dans l'ensemble chromosomique des mâles, contrairement aux femelles armées d'une paire de chromosomes X, il n'y a qu'un seul chromosome sexuel - X (le deuxième chromosome sexuel exclusivement masculin, Y, comme il ressort de nombreuses études, sur plusieurs millions d'années d'évolution a progressivement dégénéré, ne conservant dans sa composition, en fait, que la collection minimale de gènes nécessaires à la procréation), divers dommages ou mutations aléatoires de gènes dans ce chromosome X mâle sont beaucoup plus susceptibles de rester impunis et sont hérités par les hommes descendance sur la base du lien sexuel.
Quant au chromosome mâle spécifique notoire, les biologistes américains ont suggéré qu'il s'agissait très probablement d'une version fortement tronquée de l'autre chromosome sexuel décrit peu de temps auparavant, conventionnellement nommé X. Le chromosome mâle tronqué a reçu le préfixe de lettre Y, les mâles ont acquis une désignation alternative. XY (puisqu'une copie des chromosomes X et Y a été identifiée dans leurs cellules germinales), tandis que les femmes avec un double jeu de chromosomes X ont reçu l'abréviation XX.
Au cours des nombreuses décennies qui se sont écoulées depuis cette découverte la plus importante, les généticiens n'ont pas vraiment réussi à reconstituer leurs maigres connaissances sur la structure interne et les caractéristiques du travail des chromosomes, et ce n'est qu'à la fin du siècle dernier, une recherche minutieuse de l'information a commencé à apporter des résultats notables. Le processus de séquençage (décodage grossier) des génomes de divers organismes vivants mis en service a permis aux scientifiques en très peu de temps de faire des progrès significatifs dans la compréhension des processus biologiques de base, dont le plus important, bien entendu, est le mécanisme de transmission des informations héréditaires.
La première version préliminaire du chromosome X sexuel humain, dans laquelle, cependant, il y avait des lacunes importantes, a été obtenue par des généticiens en 2001. Il y a deux ans, un groupe de spécialistes dirigé par l'Américain David Page du Massachusetts Institute of Technology a été le premier à décrire la séquence génétique complète du chromosome Y humain. Fin 2004, les scientifiques disposaient d'informations détaillées sur la structure des chromosomes "ordinaires" (non sexuels) 5, 6, 7, 9, 10, 13, 14, 19, 20, 21, 22 (tous les chromosomes non sexuels sont appelés autosomes et ne diffèrent formellement que par le nombre ...
Le 18 mars 2005, une équipe de scientifiques, dont le noyau était des chercheurs du British Wellcome Trust Sanger Institute (Cambridge), a publié dans la revue Nature l'analyse la plus détaillée du chromosome X à ce jour, basée sur le déchiffrement de 99,3 % des son code génétique total. La décomposition du plus gros chromosome du génome humain (sa taille totale est de 155 millions de paires de bases) en ses constituants primaires est une tâche qui a nécessité les efforts titanesques de plusieurs milliers de scientifiques, ainsi que des ordinateurs et des applications les plus puissants.
À en juger par la publication, déjà déclarée sensationnelle par un certain nombre de médias mondiaux, la "théorie du déséquilibre" est en train de devenir généralement acceptée dans la science moderne. Sur les 1098 gènes trouvés sur le chromosome X (et cela représente environ 4% du nombre total de tous les gènes humains), plus de trois cents sont directement ou indirectement liés à diverses maladies héréditaires, ce qui, à son tour, est plus de 10% de tous les gènes connus de la science.
Comme l'a noté le chef du groupe de recherche du British Sanger Institute, le Dr Mark Ross, « les troubles génétiques sur le chromosome X se manifestent principalement chez les hommes, car ce dernier manque d'une copie « de rechange » (saine) de ce chromosome, tandis que les femmes ont des conséquences négatives des mutations génétiques dans un chromosome X, en règle générale, sont nivelées en raison de l'activité compensatrice efficace du deuxième chromosome X. "
Jusqu'à présent, les généticiens ont clairement identifié 168 de ces "mauvais gènes" sur le chromosome X. Les exemples les plus typiques de maladies purement masculines, dont les coupables sont ces gènes, sont l'hémophilie, la dystrophie de Duchenne, dans laquelle se produit une atrophie musculaire, le syndrome de Duncan (une maladie du système immunitaire), le syndrome d'Alport (maladie des reins), etc.
De plus, des mutations dans les gènes du chromosome X sont à l'origine de diverses formes de retard mental, qui sont également plus sensibles chez les hommes. Ainsi, selon l'académicien de l'Académie russe des sciences médicales, directeur du Centre de recherche en génétique médicale Yevgeny Ginter, à ce jour, plus de trois douzaines de gènes ont déjà été identifiés dans le chromosome X, à un degré ou à un autre liés à cette maladie. , et, très probablement, la liste noire sera toujours réapprovisionnée.
Et enfin, l'une des découvertes les plus désagréables : environ 10 % des gènes du chromosome X appartiennent à une famille particulière, dont les membres sont soupçonnés d'être impliqués dans le cancer. Cependant, les informations dont dispose la médecine moderne sur ces gènes sont encore extrêmement rares, de sorte que les scientifiques ne sont pas pressés de tirer des conclusions de grande envergure sur ce point.
Parmi la quantité pas trop importante d'informations positives présentées par les auteurs du décodage du chromosome X, la plus répliquée, bien sûr, doit être considérée comme les données raffinées sur le fonctionnement du deuxième chromosome X dans le corps féminin. Les scientifiques ont longtemps été intrigués par le fait que les femmes ont deux chromosomes X contenant un double ensemble de gènes identiques, tandis que les hommes sont obligés de se débrouiller avec un petit talon Y, qui contient un ordre de grandeur moins de gènes (à partir de 2003, dans le Sur le chromosome Y, seuls 78 gènes ont été trouvés, 54 ayant des correspondances fonctionnelles dans l'ensemble X). En d'autres termes, il s'avère que chaque femme dans son ensemble a 4 à 5 % de gènes en plus que n'importe quel homme.
Au début des années 60 du siècle dernier, la généticienne britannique Mary Lyon, qui a étudié les facteurs génétiques affectant la spécificité de la couleur du pelage chez les souris femelles, est arrivée à une conclusion très inattendue : dans chaque cellule du corps féminin, un seul chromosome X fonctionne, et le second est silencieux, étant pratiquement complètement inactivé. De plus, comme il s'est avéré plus tard, cette déconnexion du deuxième chromosome X dans les cellules des femelles, qui est déclenchée chez presque tous les mammifères (y compris l'homo sapiens), se produit même pendant le développement embryonnaire.
Les mécanismes génétiques spécifiques qui assurent l'arrêt des chromosomes X de réserve dans les cellules féminines n'ont jusqu'à présent été étudiés que dans les termes les plus généraux. Ainsi, ce n'est qu'au milieu des années 90 que les généticiens ont découvert que le principal contrôleur de ce processus était un gène spécial Xist, situé sur le chromosome X lui-même. Ce gène produit de très grosses molécules d'ARN spécifique (appelé aussi XIST, uniquement en majuscules) qui n'agit que sur le chromosome X qui l'a produit. Se propageant le long du chromosome à partir du lieu de synthèse, les molécules XIST l'enveloppent, comme un cocon, et le rendent ainsi inefficace.
Or, selon les dernières études des généticiens, confirmées, entre autres, par les auteurs de la publication dans Nature, en fait, tout ce processus d'inactivation du deuxième chromosome X dans les cellules femelles est loin d'être parfait : de nombreux gènes du Le chromosome X apparemment inactif s'échappe d'une manière ou d'une autre de Xist et, comme si de rien n'était, continue à produire des protéines qui dupliquent la production de leurs homologues sur le chromosome X normal.
L'un des auteurs de l'article de Nature, professeur à la Duke University (USA) Huntington Willard, estime qu'« il est possible que ce soit précisément dans l'inadéquation du niveau d'expression des gènes entre les sexes qui se trouve la raison de leurs différences à la fois en genre (modèles sociaux de comportement des hommes et des femmes), et les mécanismes de base de la défense de l'organisme contre les maladies héréditaires ».
La proportion de ces gènes « non désactivés » dans les chromosomes X féminins de rechange, selon les experts de l'Institut Sanger, varie de 15 à 25 % (15 % est la barre inférieure ; de nombreuses femmes interrogées avaient une activité génétique plus élevée ). Encore une fois, les raisons et les mécanismes de cette incohérence génétique dans le travail des chromosomes X féminins ne sont toujours pas clairs. Commentant un autre mystère de la nature, l'académicien Ginter a simplement haussé les épaules avec stupéfaction : « Sur la base des résultats obtenus, on peut dire qu'en général, le niveau d'expression des gènes chez les femmes est plus élevé que chez les hommes, et cette dose varie également considérablement. chez les femmes, mais il semble qu'elles vivent elles sont les mêmes."
Un autre sujet important, sur lequel l'attention a de nouveau été attirée par les dernières études sur la structure des gènes du chromosome X, est celui des particularités de l'évolution historique des chromosomes sexuels humains. Selon Evgeny Ginter, c'est le bloc évolutif de la publication de mars qui présente le plus grand intérêt pour la grande science.
Selon la théorie la plus populaire de l'origine des sexes, initialement, c'est-à-dire à partir du moment où la vie est née sur notre planète, et, très probablement, jusqu'au milieu de la période de domination des dinosaures (300 millions d'années av. ), il n'y avait pas de mécanisme génétique spécial pour séparer les sexes sur Terre. Chez les mêmes reptiles (y compris les modernes), le sexe de la progéniture est déterminé exclusivement par la température du milieu extérieur dans lequel l'œuf fécondé mûrit: à une température, la femelle éclot de l'œuf, à une autre, le mâle.
À un moment donné, cela n'est pas encore tout à fait clair pour la science, dans un certain nombre d'espèces parmi les plus progressistes, qui devraient inclure les puces, les papillons, les oiseaux et, bien sûr, les nouveaux héros de l'évolution - les mammifères, à partir de l'ensemble standard commun de chromosomes pour aussi des raisons pas tout à fait claires pour lesquelles les chromosomes sexuels ont été attribués.
En particulier, comme le pensent les généticiens, les ancêtres chromosomiques des chromosomes sexuels humains modernes X et Y étaient les autosomes de poulet non spécialisés N1 et N4. De plus, au début, ces nouveaux chromosomes sexuels ne différaient en rien les uns des autres, sauf que Y portait le gène de la détermination masculine, et X non. La même similitude initiale est mise en évidence par le fait que plus de la moitié des quelques gènes conservés aujourd'hui sur le chromosome Y ont une paire sur le chromosome X.
Cependant, au cours de l'évolution ultérieure, des mutations ont commencé à s'accumuler dans les gènes initialement presque identiques de ces chromosomes, et les structures génétiques de X et Y ont commencé à différer de plus en plus les unes des autres.
De nombreux généticiens pensent que le triste sort du chromosome Y non apparié était une fatalité immédiatement après la séparation des chromosomes en sexe et somatique. Manquant, contrairement au chromosome X, de mécanismes efficaces pour la réparation et la restauration des gènes endommagés, le chromosome Y a commencé à perdre progressivement une à une ces "unités d'hérédité" et, selon les prévisions des fatalistes, dans les deux cent mille suivants. années devront se transformer soit en un mannequin génétique qui ne porte aucune information héréditaire, soit complètement disparaître du génome.
Si nous partons de considérations formelles, la théorie de la mort imminente d'un homme semble bien sûr tout à fait logique. En effet, si l'on se base sur le génome humain, alors, en fait, il n'y a quasiment plus d'"enregistrements significatifs" sur le chromosome Y, alors qu'initialement environ 1000 gènes y étaient localisés, ainsi que sur le chromosome X . La plupart des 78 gènes du chromosome Y qui subsistent aujourd'hui ont une spécialisation extrêmement étroite et sont responsables de la formation des spermatozoïdes et du développement des testicules.
Le chromosome mâle, le fameux Y, est différent des 45 autres inclus dans l'ensemble de gènes humains normaux. Elle n'a pas de compagnon. C'est elle qui est plus inhérente à une variété de mutations. Comme le disent certains chercheurs, dans un avenir proche, la civilisation sera confrontée à la disparition complète de cet élément. D'autre part, les dernières recherches ont montré que le processus de reproduction peut facilement se dérouler sans la participation de ce chromosome.
Que disent les scientifiques ?
Selon les chercheurs, les chromosomes mâles disparaîtront dans les dix prochains millions d'années. Bien sûr, il n'y a aucune certitude à ce sujet, mais les prévisions sont confirmées par des calculs assez fiables. Cela se produira en raison de la perte de fonctionnalité de l'élément de structure de l'ADN.
Déjà aujourd'hui, on sait de manière fiable que les chromosomes mâles diffèrent considérablement des autres, y compris X, car ils ne peuvent pas échanger d'informations génétiques pendant le processus de reproduction. Cela a conduit à la perte de matériel héréditaire et à l'accumulation de diverses mutations transmises entre les générations. Cependant, les scientifiques font attention : la présence de ce chromosome particulier, ou plutôt son absence, ne deviendra pas un obstacle à l'établissement de la descendance.
Dernières recherches
Souvent après cela, il y a des informations plutôt invraisemblables sur les extraterrestres, mais pas dans notre cas. Les scientifiques ont en fait découvert exactement quand les chromosomes se sont formés comme outil pour déterminer le sexe du fœtus. Auparavant, on croyait que cela s'était produit pour la première fois il y a trois millions de siècles. Des travaux de recherche menés dans un passé récent ont montré : 166 millions d'années avant notre ère, les chromosomes mâles et femelles étaient absents dans le pool génétique de notre espèce.

Beaucoup adhèrent à la théorie selon laquelle les chromosomes sexuels (masculins, féminins) ont le même ensemble de gènes qu'une source. Dans les temps anciens, l'évolution des mammifères a conduit à l'émergence d'un gène dont l'allèle est devenu la base du type d'organisme mâle. L'allèle dans la science moderne s'appelle Y, tandis que le second a commencé à être désigné par X. C'est-à-dire qu'au début, il y avait des chromosomes presque identiques, la différence résidait dans un gène. Au fil du temps, Y est devenu un vecteur d'information génétique, plus utile pour la moitié mâle du genre, mais pas important ou nocif pour la femelle.
Quelques caractéristiques du corps humain
Les chercheurs, découvrant les caractéristiques spécifiques des chromosomes mâles et femelles, ont découvert que Y n'est pas capable de se recombiner avec X au cours de la gamétogenèse, c'est-à-dire au moment où les cellules germinales mûrissent. Par conséquent, les changements possibles sont provoqués exclusivement par des mutations. L'information génétique générée au cours d'un tel processus ne peut pas être évaluée par des mécanismes naturels comme le mariage, et il n'y a pas de dilution par des variations génétiques. Par conséquent, le père donne au fils l'ensemble complet - et ainsi de suite, génération après génération. Petit à petit, le nombre de modifications s'accumule.
Le processus de maturation des cellules germinales est associé à la division, caractéristique des spermatozoïdes. Chacune de ces divisions est une autre possibilité de mutations supplémentaires s'accumulant dans le chromosome sexuel masculin. L'acidité de l'environnement dans lequel ce processus se déroule joue également un rôle - ce facteur provoque en outre des mutations imprévues. Les scientifiques ont découvert que statistiquement Y est le chromosome le plus fréquemment endommagé de l'ensemble des gènes.
C'était, c'était, ce sera
Actuellement, le nombre de gènes sur le chromosome Y, comme le disent les scientifiques, n'est pas inférieur à 45, mais pas supérieur à 90. Les estimations spécifiques diffèrent quelque peu, cela dépend des méthodes utilisées par les chercheurs. Mais le chromosome sexuel féminin contient près d'un millier et demi de gènes. Cette différence est due à des processus évolutifs qui ont conduit à la perte d'informations génétiques.

Autrefois, les scientifiques, étudiant la dynamique du chromosome Y, estimaient qu'en moyenne, environ 4,6 gènes avaient été perdus en un million d'années. Si cette progression se poursuit dans le futur, l'information entièrement génétique à travers cet objet cessera d'être transférée dans les dix prochains millions d'années.
Une approche alternative
Bien sûr, X et Y sont des chromosomes dont l'étude, en principe, est devenue accessible à l'humanité assez récemment. Par conséquent, la plupart des scientifiques ne disposent que de calculs théoriques, sans données confirmées par des observations pratiques, qui sont toujours associées à une faible probabilité d'erreur. et écart. Déjà, certains sont convaincus que l'opinion ci-dessus est incorrecte.
Des recherches spécialisées ont été menées au Whitehead Institute. Les scientifiques, examinant l'ensemble mâle de chromosomes, sont arrivés à la conclusion que la décomposition génétique s'était complètement arrêtée. Ce n'était qu'une étape évolutive associée aux caractéristiques du corps humain, et à l'heure actuelle un état stable a été atteint, qui le restera pendant au moins dix millions d'années.
Comment cela s'est passé
L'étude alternative susmentionnée sur les chromosomes X et Y impliquait le séquençage de 11 millions de paires de bases du chromosome mâle. Les données génétiques des singes rhésus ont été prélevées comme échantillons expérimentaux. La séquence obtenue au cours des travaux a été comparée à la section correspondante du chromosome mâle des chimpanzés, et un échantillon d'information génétique humaine a été prélevé comme témoin. Sur la base des données obtenues, il a été possible de confirmer l'hypothèse de la constance du contenu génétique des chromosomes des hommes pendant 25 millions d'années.

L'un des auteurs de cette étude est Jennifer Hughes, qui a expliqué que Y (la désignation du chromosome mâle) n'avait perdu qu'un seul gène, ce qui est remarquablement différent des échantillons expérimentaux obtenus à partir de macaques. Cela témoigne que dans le temps le plus proche (cependant, il est possible d'appeler cela des intervalles de temps mesurés en millions d'années seulement de manière conditionnelle) temps, aucune perte d'un chromosome ne menacera l'humanité.
Est-ce effrayant?
Actuellement, les scientifiques savent exactement quel chromosome est responsable du sexe de l'enfant à naître : cela dépend de cette très 23ème paire, qui dans le corps masculin n'est même pas représentée par la même paire, car XX est caractéristique pour les femmes, et XY pour les hommes ... Par conséquent, les théories sur la disparition possible de Y inquiètent beaucoup : l'humanité s'éteindra-t-elle alors ? Allons-nous devenir du même sexe ?
Les scientifiques assurent qu'il n'y a aucune raison de s'inquiéter. Il n'y a pas si longtemps, des études organisées dans un institut scientifique à Hawaï ont clairement montré qu'une descendance saine est tout à fait possible avec deux gènes sur le chromosome mâle - et cela s'applique aux souris. Cela signifie qu'à l'avenir, il sera possible de contourner complètement ce chromosome et de se multiplier avec succès sans lui. Ceci s'applique également à la personne. Les scientifiques sont attentifs : ces résultats de recherche ne sont pas seulement importants pour ceux qui craignent pour le sort de l'humanité dans un avenir lointain. Il est fort possible qu'ils aident à trouver la réponse aux questions sur l'élimination de l'infertilité masculine.
Comment l'expérience a été menée
Le flux de travail des chercheurs impliquait d'interagir avec les cellules reproductrices de souris mâles. Ils ont été travaillés, ne laissant que deux gènes du chromosome mâle. L'un d'eux est responsable de la formation de la structure masculine du corps, y compris le développement hormonal, la spermatogenèse et le second du facteur de prolifération.

Au cours de la recherche, il est devenu clair que le gène qui détermine la prolifération des spermogonies est le seul gène dont le système reproducteur des souris a vraiment besoin pour la formation de la progéniture.
Que s'est-il passé ensuite ?
Pour tester les résultats de leurs découvertes théoriques, en laboratoire, les scientifiques ont fécondé des œufs de souris en utilisant des chromosomes mâles améliorés. Pour cela, une méthode d'injection intracytoplasmique de haute précision a été utilisée. Les embryons qui se sont développés ont été implantés dans l'organisme féminin - dans l'utérus.

Les statistiques ont montré : 9 % de toutes les grossesses ont réussi et la progéniture est née en parfaite santé. Mais si le processus de reproduction a lieu avec la participation d'une telle souris mâle, dont le chromosome n'a pas été modifié, le pourcentage de grossesses réussies sans anomalies dans le développement de la progéniture n'est que de 26%. Cela indique clairement que le chromosome sexuel masculin pourrait devenir à l'avenir seulement une relique des millénaires passés. Il sera probablement possible de trouver sur d'autres chromosomes de tels éléments responsables de l'information génétique qui ont une correspondance avec le chromosome mâle. Si vous activez leur fonctionnalité, l'objet en question deviendra complètement redondant.
Oncologie et génétique
Il y a quelque temps, des études ont été publiées, à partir desquelles découle la dépendance de la probabilité de développer des néoplasmes malins et de la perte du chromosome mâle. Cela se voit parfois dans la vieillesse. Tout d'abord, les leucocytes sont touchés. Les scientifiques ont également découvert qu'il s'agit de l'une des causes de décès précoce : les hommes présentant des modifications génétiques meurent généralement plus tôt, mais les femmes vivent plus longtemps.

Pour la première fois, ce phénomène a été décrit il y a environ un demi-siècle, mais les conséquences, ainsi que les raisons, restent à ce jour un secret pour le public aux sept sceaux. Dans le cadre d'une étude en Suède, des échantillons de sang ont été prélevés sur 1153 personnes âgées de 70 à 84 ans. Nous n'avons étudié que des échantillons de sang d'hommes, et l'échantillon provenait de personnes qui étaient régulièrement observées dans les cliniques de l'État au moins à partir de l'âge de quarante ans. Les données recueillies ont clairement montré que la perte du chromosome mâle est caractéristique de ceux dont l'espérance de vie est inférieure d'environ 5,5 ans par rapport aux hommes qui n'ont pas été confrontés à un tel changement. Si le nombre de leucocytes avec une information génétique altérée augmentait, la probabilité de décès causé par des processus malins augmentait.
Stéréotypes et informations fiables
Il est généralement admis que le Y est le chromosome qui détermine le sexe de l'enfant, et par là ses fonctions sont épuisées. En fait, l'information génétique qu'il stocke est importante pour de nombreuses fonctions. Les scientifiques espèrent que ce sera grâce à l'étude des caractéristiques de ce chromosome qu'il sera possible d'inventer un médicament efficace contre les tumeurs. Les médecins pensent que la perte d'un chromosome avec l'âge entraîne un affaiblissement du système immunitaire. Ceci, à son tour, crée des conditions pour la croissance de cellules malignes.
Elena Shvedkina à propos de l'une des maladies génétiques les plus courantes - les patients se plaignent d'infertilité, de dysfonction érectile, de gynécomastie et d'ostéoporose
Le syndrome de Klinefelter- une maladie génétique caractérisée par un chromosome sexuel féminin supplémentaire X(un ou même plusieurs) dans le caryotype masculin XY... Dans le même temps, il n'y a pas assez d'hormones sexuelles formées dans les gonades mâles - les testicules.
Comme vous le savez, l'ensemble génétique d'une personne comporte 46 chromosomes, dont 22 paires sont dites somatiques et la 23e paire est sexuelle. Les femmes ont une paire de chromosomes sexuels XX, et les hommes - XY... Pour le syndrome de Klinefelter, la présence d'un chromosome Y mâle est donc obligatoire, malgré les X-chromosomes, les patients sont toujours des hommes.
Classification : types de caryotypes dans le syndrome de Klinefelter
Par le nombre de chromosomes X supplémentaires, on distingue les variantes suivantes du syndrome de Klinefelter:
- 47, XXY- le plus courant
- 48, XXXY
- 49, XXXY
De plus, les caryotypes masculins sont également référés au syndrome de Klinefelter, qui comprennent, en plus d'autres X-chromosome, supplémentaire Oui-chromosome - 48, XXYY... Et, enfin, parmi les patients atteints de ce syndrome, il y a des personnes avec un caryotype en mosaïque. 46, XY/47, XXY(c'est-à-dire que certaines cellules ont un jeu de chromosomes normal).
L'histoire de la découverte du syndrome
Le syndrome a obtenu son nom en l'honneur de Harry Klinefelter, un médecin qui, en 1942, a décrit pour la première fois le tableau clinique de la maladie. Klinefelter et ses collègues ont publié un rapport sur une étude portant sur 9 hommes partageant des symptômes communs tels qu'une mauvaise pilosité, un type de corps eunuque, une grande taille et des testicules réduits. Plus tard, en 1956, les généticiens Plankett et Barr (E.R. Plankett, M.L. Barr) ont trouvé des corps de chromatine sexuelle dans les noyaux des cellules de la muqueuse buccale chez les hommes atteints du syndrome de Klinefelter, et en 1959 Polany et Ford (P E. Polanyi, SE Ford) avec des collègues ont montré que les patients de l'ensemble chromosomique ont un X-chromosome.
Des recherches actives sur cette pathologie ont été menées dans les années 70 aux États-Unis. Ensuite, tous les garçons nouveau-nés ont été soumis à un caryotypage, ce qui a permis d'identifier de manière fiable la prévalence et les caractéristiques génétiques du syndrome de Klinefelter.
Il est intéressant de noter que les souris peuvent également être atteintes du syndrome de trisomie du chromosome sexuel XXY, ce qui leur permet d'être utilisées efficacement comme modèles pour l'étude du syndrome de Klinefelter.
La prévalence de la maladie
Le syndrome de Klinefelter est l'une des maladies génétiques les plus courantes : pour 500 nouveau-nés garçons, il y a 1 enfant atteint de cette pathologie.
De plus, le syndrome de Klinefelter est la troisième pathologie endocrinienne la plus fréquente chez l'homme (après le diabète sucré et la pathologie thyroïdienne) et la cause la plus fréquente de troubles congénitaux de la reproduction chez l'homme.
À ce jour, environ la moitié des cas de syndrome de Klinefelter restent méconnus. Souvent, ces patients demandent de l'aide pour l'infertilité, la dysfonction érectile, la gynécomastie, l'ostéoporose, l'anémie, etc. sans diagnostic préalable.
Étiologie et causes de violation
Le syndrome de Klinefelter fait référence à des maladies génétiques qui ne sont pas héréditaires, car les patients, à de rares exceptions près, sont infertiles. La pathologie, en règle générale, survient à la suite d'une violation de la divergence des chromosomes aux premiers stades de la formation des ovules et des spermatozoïdes. Dans le même temps, le syndrome de Klinefelter, qui survient en raison d'une violation des cellules reproductrices féminines, survient trois fois plus souvent. Les formes mosaïques sont causées par la pathologie de la division cellulaire aux premiers stades de l'embryogenèse ; par conséquent, certaines des cellules de ces patients ont un caryotype normal. Les raisons de la non-disjonction des chromosomes sexuels et des troubles de la division cellulaire aux premiers stades de l'embryogenèse sont encore mal comprises. Contrairement à d'autres maladies chromosomiques, l'influence de l'âge des parents est absente ou insignifiante.
Signes précoces
Contrairement à la plupart des maladies associées à une violation du nombre de chromosomes, le développement intra-utérin des enfants atteints du syndrome de Klinefelter est normal, il n'y a pas de tendance à l'interruption prématurée de la grossesse. Ainsi, dans la petite enfance et la petite enfance, il est presque impossible de suspecter une pathologie. De plus, les signes cliniques du syndrome de Klinefelter classique n'apparaissent, en règle générale, qu'à l'adolescence. Cependant, il existe des symptômes suggérant la présence du syndrome de Klinefelter dans la période prépubère :
- forte croissance (le pic de l'augmentation de la croissance se produit entre 5 et 8 ans);
- longues jambes (physique disproportionnée);
- taille haute.
Chez certains patients, il y a un certain retard dans le développement de la parole.
À l'adolescence, le syndrome se manifeste souvent par une gynécomastie qui, avec cette pathologie, se présente sous la forme d'un élargissement bilatéral symétrique et indolore des glandes mammaires. Étant donné que ce type de gynécomastie est souvent observé chez des adolescents en parfaite santé, ce symptôme est souvent négligé. Normalement, la gynécomastie adolescente disparaît sans laisser de trace en quelques années, tandis que chez les patientes atteintes du syndrome de Klinefelter, l'involution inverse des glandes mammaires ne se produit pas. Dans certains cas, la gynécomastie peut ne pas se développer du tout, puis la pathologie se manifeste par des signes de carence en androgènes déjà dans la période postpubertaire.
Symptômes de carence en androgènes dans le syndrome de Klinefelter
La carence en androgènes dans le syndrome de Klinefelter est associée à une atrophie testiculaire progressive, qui entraîne une diminution de la synthèse de testostérone. Le degré de carence en androgènes varie considérablement.
Tout d'abord, l'attention est attirée sur les signes externes d'hypogonadisme :
- poils du visage rares ou son absence totale;
- croissance des poils pubiens de type féminin;
- il manque des poils sur la poitrine et d'autres parties du corps ;
- petit volume de testicules (2-4 ml) et leur consistance dense (signe pathognomonique).
Étant donné que la dégénérescence des gonades se développe généralement dans la période postpubertaire, chez la plupart des patients, la taille des organes génitaux masculins, à l'exception des testicules, correspond aux normes d'âge.
Les patients peuvent se plaindre d'un affaiblissement de la libido et d'une diminution de la puissance. De nombreux hommes atteints du syndrome de Klinefelter n'ont pas du tout de libido et certains, au contraire, ont une famille et une vie sexuelle normale. Le signe le plus constant de la pathologie est l'infertilité, c'est ce qui devient le plus souvent la raison pour laquelle ces patients vont chez le médecin. Le syndrome de Klinefelter est présent chez 10 % des hommes atteints d'azoosémie.
Tous les patients présentant une spermatogenèse altérée doivent déterminer le caryotype pour exclure ou confirmer le diagnostic du syndrome de Klinefelter.
La carence en androgènes conduit au développement de l'ostéoporose, de l'anémie et de la faiblesse des muscles squelettiques. Chez un tiers des patients, des varices des jambes peuvent être observées.
Les androgènes affectent le métabolisme, c'est pourquoi les patients atteints du syndrome de Klinefelter sont sujets à l'obésité, à une intolérance au glucose et au diabète de type 2.
La prédisposition de ces patients aux maladies auto-immunes (polyarthrite rhumatoïde, lupus érythémateux disséminé, maladies auto-immunes de la glande thyroïde et autres) a été prouvée.
Caractéristiques psychologiques
Le quotient intellectuel chez les patients atteints du syndrome de Klinefelter classique varie de valeurs inférieures à la moyenne à des valeurs significativement supérieures à la moyenne. Cependant, dans tous les cas, il existe une disproportion entre le niveau général d'intelligence et les capacités verbales, de sorte que souvent les patients ayant un QI suffisamment élevé éprouvent des difficultés à percevoir de grandes quantités de matériel à l'oreille, ainsi qu'à construire des phrases contenant des constructions grammaticales complexes. . De telles caractéristiques causent beaucoup de problèmes aux patients pendant la période de formation et continuent souvent d'affecter les activités professionnelles.
Les données sur les caractéristiques psychologiques des patients atteints du syndrome de Klinefelter sont plutôt contradictoires, cependant, la plupart des experts évaluent les patients comme des personnes modestes et timides avec une faible estime de soi et une sensibilité accrue. Il est prouvé que les patients atteints du syndrome de Klinefelter sont sujets à l'homosexualité, à l'alcoolisme et à la toxicomanie. Il est difficile de dire si les caractéristiques mentales de ces patients sont causées par l'influence directe d'une anomalie chromosomique ou s'il s'agit d'une réaction à des problèmes dans la sphère sexuelle.
En ce qui concerne les différentes variantes cytogénétiques du syndrome de Klinefelter, la règle est vraie qu'avec une augmentation du nombre de X-chromosomes, le nombre et la gravité des symptômes pathologiques augmentent.
Diagnostic du syndrome de Klinefelter
Dans de nombreux pays, le syndrome de Klinefelter est souvent diagnostiqué avant même la naissance d'un enfant, car de nombreuses femmes en âge de procréer tardivement, en raison du risque élevé de malformations génétiques chez la future progéniture, utilisent le diagnostic génétique prénatal du fœtus. Souvent, la détection prénatale du syndrome de Klinefelter est un motif d'interruption de grossesse, y compris sur recommandation des médecins. En Russie, l'analyse du caryotype d'un enfant à naître est extrêmement rare.
Si le syndrome de Klinefelter est suspecté, un test sanguin de laboratoire est effectué pour déterminer le niveau d'hormones sexuelles mâles. Un diagnostic différentiel avec d'autres maladies survenant avec des manifestations de déficit androgénique est requis. Un diagnostic précis du syndrome de Klinefelter est fait sur la base de l'étude du caryotype (ensemble de chromosomes) du patient.
Recherche nécessaire pour confirmer le diagnostic
Chez tous les hommes présentant une forte augmentation des concentrations de gonadotrophines, il est nécessaire d'exclure le syndrome de Klinefelter, car souvent le premier signe de laboratoire de cette pathologie génétique est une augmentation de la concentration de gonadotrophines dans le sang avec une teneur normale en testostérone totale.
Le syndrome de Klinefelter doit être différencié des autres formes d'hypogonadisme primaire. Dans tous les cas, avec une augmentation du taux de FSH dans le sang, il est nécessaire de déterminer le caryotype pour exclure tout d'abord le syndrome de Klinefelter.
Traitement
Objectifs du traitement du syndrome de Klinefelter :
- Restaurer des niveaux normaux de testostérone
- Restauration de la fonction sexuelle
- Élimination des troubles métaboliques
En cas de pathologie cliniquement sévère, un traitement substitutif à vie par des médicaments à base de testostérone est nécessaire. Une thérapie adéquate permet non seulement d'améliorer l'apparence et le bien-être général du patient, mais également de restaurer la capacité à une vie sexuelle normale. De plus, la thérapie de remplacement prévient le développement de l'ostéoporose, soulage la faiblesse musculaire. À un jeune âge, le traitement doit être commencé immédiatement après le diagnostic. Avec le syndrome de Klinefelter, il est préférable d'utiliser des préparations de testostérone à action prolongée:
- un mélange d'esters de testostérone sous forme de solution d'huile, dont les injections doivent être effectuées 2 à 3 fois par mois;
- undécanoate de testostérone sous forme de solution huileuse - préparation dépôt à libération retardée de la substance active - injections une fois tous les 3 mois.
Le traitement hormonal en présence du chromosome X chez l'homme doit être permanent. La dose du médicament est choisie individuellement sous le contrôle des taux sériques de testostérone et de LH.
La gynécomastie déjà développée dans le syndrome de Klinefelter ne subit pas d'involution même en cas de traitement adéquat, il est donc souvent nécessaire de recourir à une correction chirurgicale (mastectomie).
Pour la prévention des comorbidités telles que l'obésité et le diabète de type 2, il est conseillé aux patients de suivre un régime et de surveiller leur propre poids.
Les patients atteints du syndrome de Klinefelter doivent être surveillés au moins tous les 6 à 12 mois. Il doit comprendre les études suivantes :
- une formule sanguine complète pour évaluer le taux d'hémoglobine et d'hématocrite ;
- test sanguin hormonal, y compris la détermination de la testostérone et de la LH (effectué dans le cadre d'un traitement médicamenteux 1 à 2 jours avant la prochaine injection de testostérone);
Les chromosomes sont des molécules filiformes qui transportent des informations héréditaires pour tout, de la taille à la couleur des yeux. Ils sont fabriqués à partir d'une protéine et d'une seule molécule d'ADN, qui contient les instructions génétiques du corps, transmises par les parents. Chez les humains, les animaux et les plantes, la plupart des chromosomes sont situés par paires dans le noyau cellulaire. Les humains possèdent 22 de ces paires de chromosomes, appelées autosomes.
Les humains ont 22 paires de chromosomes et deux chromosomes sexuels. Les femmes ont deux chromosomes X ; les mâles ont un chromosome X et un chromosome Y.
Comment le genre est déterminé
Les humains ont une paire supplémentaire de chromosomes sexuels pour un total de 46 chromosomes. Les chromosomes sexuels sont appelés X et Y, et leur combinaison détermine le sexe d'une personne. En règle générale, les femmes ont deux chromosomes X, tandis que les hommes ont des chromosomes XY. Ce système de sexage XY se trouve chez la plupart des mammifères ainsi que chez certains reptiles et plantes.
La présence de chromosomes XX ou XY est déterminée lorsque le spermatozoïde féconde l'ovule. Contrairement aux autres cellules du corps, les cellules de l'ovule et du sperme, appelées gamètes ou cellules sexuelles, n'ont qu'un seul chromosome. Les gamètes sont produits par division cellulaire au cours de la méiose, ce qui fait que les cellules séparées ont la moitié du nombre de chromosomes en tant que parents ou progéniteurs. Dans le cas de l'homme, cela signifie que les cellules mères ont deux chromosomes et qu'elles ont un gamète.
Tous les gamètes des ovules maternels ont des chromosomes X. Le sperme du père contient environ la moitié des chromosomes X et la moitié des chromosomes Y. Le sperme est un facteur variable dans la détermination du sexe d'un enfant. Si le spermatozoïde porte le chromosome X, il se combinera avec le chromosome X de l'ovule pour former un zygote féminin. Si le sperme porte le chromosome Y, cela conduira à la naissance d'un garçon.
Lors de la fécondation, les gamètes du sperme se combinent avec les gamètes de l'ovule pour former un zygote. Le zygote contient deux ensembles de 23 chromosomes pour les 46 requis. La plupart des femmes sont 46XX et la plupart des hommes sont 46XY, selon l'Organisation mondiale de la santé.
Cependant, il existe certaines options. Des recherches récentes ont montré qu'une personne peut avoir de nombreuses combinaisons différentes de chromosomes sexuels et de gènes, en particulier ceux qui s'identifient comme LGBT. Par exemple, un chromosome X spécifique appelé Xq28 et un gène sur le chromosome 8 semblent être trouvés à une prévalence plus élevée chez les hommes gais, selon une étude de 2014 dans la revue Psychological Medicine.
Plusieurs bébés sur mille naissent avec un seul chromosome sexuel (45X ou 45Y), c'est ce qu'on appelle la monosomie. D'autres naissent avec trois chromosomes sexuels ou plus (47XXX, 47XYY ou 47XXY, etc.), c'est ce qu'on appelle la polysomie. "De plus, certains hommes naissent avec 46XX en raison de la translocation d'une infime partie du sexe qui définit la région du chromosome Y", rapporte l'OMS. «De même, certaines femmes sont également nées 46XY en raison de mutations du chromosome Y. Évidemment, non seulement les femmes qui sont XX et les hommes XY, mais il y a plutôt un certain nombre d'ajouts de chromosomes, d'équilibres hormonaux et de variations phénotypiques. »
Structure des chromosomes X et Y
Alors que les chromosomes des autres parties du corps ont la même taille et la même forme, formant un appariement identique, les chromosomes X et Y ont des structures différentes.
Le chromosome X est significativement plus long que le chromosome Y et contient des centaines de gènes supplémentaires. Étant donné que les gènes supplémentaires sur le chromosome X n'ont pas d'homologues sur le chromosome Y, les gènes X sont dominants. Cela signifie que presque n'importe quel gène sur X, même s'il est récessif chez la femelle, sera exprimé chez les mâles. Ceux-ci sont appelés gènes liés à l'X. Les gènes trouvés uniquement sur le chromosome Y sont appelés gènes liés à l'Y et ne sont exprimés que chez les mâles. Les gènes sur n'importe quel chromosome sexuel peuvent être appelés gènes sexuels.
Il existe environ 1 098 gènes liés à l'X, bien que la plupart ne concernent pas les caractéristiques anatomiques féminines. En fait, plusieurs d'entre eux sont associés à des troubles tels que l'hémophilie, la dystrophie musculaire de Duchenne et plusieurs autres. Ils sont le plus souvent trouvés chez les hommes. Les caractéristiques non sexuelles des gènes liés à l'X sont également responsables de la calvitie masculine.
Contrairement au grand chromosome X, le chromosome Y ne contient que 26 gènes. Seize de ces gènes sont responsables du maintien des cellules. Neuf sont impliqués dans la production de spermatozoïdes, et si certains sont manquants ou défectueux, un faible nombre de spermatozoïdes ou une infertilité peuvent survenir. Un gène, appelé gène SRY, est responsable des traits sexuels masculins. Le gène SRY déclenche l'activation et la régulation d'un autre gène présent sur le chromosome non sexuel appelé Sox9. Sox9 déclenche le développement des gonades non sexuelles dans les testicules au lieu des ovaires.
Anomalies des chromosomes sexuels
Des anomalies dans la combinaison des chromosomes sexuels peuvent conduire à une variété de conditions spécifiques au sexe qui sont rarement fatales.
Les anomalies féminines conduisent au syndrome de Turner ou à la trisomie X. Le syndrome de Turner survient lorsque les femmes n'ont qu'un seul chromosome X au lieu de deux. Les symptômes comprennent une défaillance génitale due à une maturité normale, ce qui peut entraîner une infertilité, de petits seins et l'absence de menstruation ; petite taille; large poitrine thyroïdienne; et un col large.
Le syndrome de la trisomie X est causé par trois chromosomes X au lieu de deux. Les symptômes comprennent une grande taille, des retards d'élocution, une insuffisance ovarienne prématurée ou des anomalies ovariennes et un faible tonus musculaire - bien que de nombreuses filles et femmes ne présentent aucun symptôme.
Le syndrome de Klinefelter peut affecter les hommes. Les symptômes comprennent le développement des seins, des proportions anormales telles que des hanches larges, une grande taille, l'infertilité et de petits testicules.